Аргинин: глицин амидинотрансфераза - Arginine:glycine amidinotransferase - Wikipedia
| Глицин амидинотрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 AGAT стандартты бағытта стерео көрінісі, модельдің жоғарғы жағында себеттің тұтқалары[1] | |||||||||
| Идентификаторлар | |||||||||
| EC нөмірі | 2.1.4.1 | ||||||||
| CAS нөмірі | 9027-35-4 | ||||||||
| Мәліметтер базасы | |||||||||
| IntEnz | IntEnz көрінісі | ||||||||
| БРЕНДА | BRENDA жазбасы | ||||||||
| ExPASy | NiceZyme көрінісі | ||||||||
| KEGG | KEGG кірісі | ||||||||
| MetaCyc | метаболизм жолы | ||||||||
| PRIAM | профиль | ||||||||
| PDB құрылымдар | RCSB PDB PDBe PDBsum | ||||||||
| Ген онтологиясы | AmiGO / QuickGO | ||||||||
| |||||||||
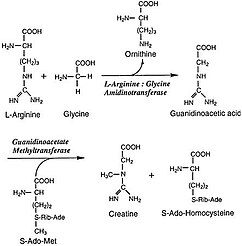

L-Аргинин: глицин амидинотрансфераза (AGAT; EC 2.1.4.1 ) болып табылады фермент тасымалдауды катализдейді амидино бастап L-аргинин дейін глицин. Өнімдер болып табылады L-орнитин және гликоциамин, сонымен қатар гуанидиноацетат деп аталады, оның тікелей ізашары креатин. Креатин және оның фосфорланған түрі бұлшықет және жүйке тіндерінің энергия алмасуында орталық рөл атқарады. Креатин қаңқа бұлшықетінде, жүректе, сперматозоидтарда және фоторецептор жасушаларында ең жоғары концентрацияда болады. Креатин жылдам өзгерістерді буферлік етуге көмектеседі ADP /ATP белсенді кезеңдердегі бұлшықет және жүйке жасушаларындағы қатынас. Креатин басқа тіндерде де синтезделеді, мысалы ұйқы безі, бүйрек, және бауыр, онда амидинотрансфераза орналасқан цитоплазма, оның ішінде мембрана аралық кеңістік туралы митохондрия, сол тіндерді құрайтын жасушалардың.[2]
Функция
L-Аргинин: глицин амидинотрансфераза біріншісін катализдейді, ол да жасалған қадам креатин түзілуінде. Нақты креатин молекуласын өндіретін процестің екінші сатысы тек қана жүреді цитозол, мұнда екінші фермент, S-аденозилметионин: гуанидиноацетат метилтрансфераза (GAMT) табылған. Содан кейін креатин қанмен тасымалданады және натрийге тәуелді креатин тасымалдаушылар арқылы креатинді қажет ететін жасушалар арқылы қабылданады.[1]
Құрылым
The кристалдық құрылым AGAT-ті Хумм, Фритше, Штайнбахер және Губер анықтады Макс Планк атындағы биохимия институты жылы Мартинсрид 1997 ж. Германия. Құрылымды рентгенологиялық зерттеу кезінде бета бета алфавит модульдерінің бес реттік псевдосимметриясымен жаңа симметрия анықталады. Молекуланың жалпы құрылымы тұтқалары бар себетке ұқсайды. Белсенді учаске ұзын, тар арнаның түбінде жатыр және Cys-His-Asp каталитикалық үштігін қамтиды. Аралық құрылым амидино тобын каталитикалық триадада Cys қалдықтарымен уақытша ковалентті байланыстыруды қамтиды, ал оның қалдықтары жалпы қышқыл / негіздік катализге қатысады, яғни ол протон доноры / қабылдағышының рөлін атқарады.[2]
Реакция
AGAT катализдейтін нақты реакция - аргинин мен глициннен гуанидиноацетат синтезі, а орнитинмен қосалқы өнім. Содан кейін өндірілген гуанидиноацетат біріктіріледі S-Аденозил-L-метионин, ГАМТ катализдейтін реакция, креатин және S-Аденозил-L-хомоцистеин. AGAT осы жасалған қадамды катализдейтін механизм а пинг-понг тетігі, және амидино тобын ақуыздағы Cys407 қалдықтарына ауыстыруды қамтиды L-аргинин, ол қалдырады L-орнитин. Содан кейін His303 қалдықтары протеинді глициннен бөліп алады, содан кейін амидино тобын Cys407-ден алады, оның орнына протон гуанидиноацетатқа айналады және катализаторды жаңартады.[2]
Көрнекілік пен белсенділікті реттеу
Гуанидиноацетаттың түзілуі әдетте креатин биосинтезінің жылдамдықты шектейтін сатысы болып табылады.[3] Демек, AGAT реакциясы - бұл жолдағы ең ықтимал басқару сатысы, көптеген эксперименттік жұмыстармен бекітілген гипотеза. Осыған байланысты ең маңыздысы - бұл жолдың соңғы өнімі - креатинмен кері байланыстың агаттық репрессиясы. Циклокреатин, N-ацетимидойлсаркозин және N-этилгуанидиноацетат репрессорлардың белсенділігін креатин сияқты көрсетеді. L-Аргинин мен гуанидиноацетаттың тек «айқын» репрессорлық белсенділігі бар. Олар AGAT экспрессиясына өздігінен әсер етпейді, бірақ креатинге тез ауысады, содан кейін ол шынайы репрессор ретінде әрекет етеді.[4] Агаттың тіндердегі белсенділігі бірнеше жолмен реттеледі, соның ішінде индукция өсу гормоны және тироксин,[5] ферменттің орнитинмен тежелуі,[6] және оның синтезінің креатинмен репрессиялануы.[7][8]
Жыныстық гормондар AGAT қызметін реттей алады.[9] Еркек егеуқұйрықтарды емдеу тестостерон пропионат AGAT белсенділігін арттырады. Қайта, эстроген емдеу AGAT белсенділігін төмендетеді және салмақ жоғалтуға әкеледі. AGAT транскрипциясы деңгейінің өзгеруі mRNA тұрақтылығының немесе транскрипция жылдамдығының жоғарылауынан пайда бола ма, жоқ па, ол әлі белгісіз. Егер эстрогеннің әсерінен болатын өзгеріс транскрипциялық реттелуден туындаса, эстрогеннің әсер ету орны әлі анықталмайды.[10]
Тінтуір плацентаның ішіндегі GATM өрнегі тек ана көшірмесін білдіретін болып көрсетілген GATM көрсетілген. Осыған байланысты, GATM плацентаның ішінде өсуді басатын рөл атқарады деп ойлайды.
Клиникалық маңызы
Жетіспеушілік
2000 жылы American Journal of Human Genetics журналы 4 және 6 жастағы екі әйел бауырластардың ақыл-есі артта және миында креатиннің жетіспеушілігі бар екенін хабарлады.[11] Аргинин: глицин амидинотрансфераза (AGAT) креатин синтезінің бірінші сатысын катализдейді, нәтижесінде креатин түзудің субстраты болып табылатын гуанидиноацетат түзіледі. Психикалық дамуы тежелген екі әйел бауырластарда, мидың креатиндік жетіспеушілігі бар, ол ауызша креатинді қоспамен қалпына келтірілген және зәрдегі гуанидиноацетат концентрациясы төмен болған, Аргинин: глицин амидинотрансфераза тапшылығы креатин алмасуындағы жаңа генетикалық ақаулық ретінде анықталды. Бұл үшеудің бірі церебральды креатиннің жетіспеушілігі.
Мидың креатин жетіспеушілігі бар науқастарда ерекше емес неврологиялық симптомдар, соның ішінде ақыл-ойдың артта қалуы, тілдік бұзылулар, эпилепсия, аутист - мінез-құлық, неврологиялық нашарлау және қозғалыстың бұзылуы сияқты. AGAT жетіспеушілігі денеде креатин тапшылығына әкеледі. Мұны емдеу креатиндік қоспалар болып табылады, өйткені дене креатинді өздігінен жасай алмайды. Креатинмен емдеудің оң нәтижелері (AGAT жетіспеушілігінде) және бұл пациенттерде ұрықтың және босанғаннан кейінгі дамудың қалыпты екенін байқау гипотезаны дәлелдейді және ерте диагноз қою және емдеу осы аурулардың соңғы болжамын едәуір жақсарта алады. Ми 1H-ХАНЫМ тексеру - бұл мидың креатиндік бұзылыстарын бағалаудың сенімді және минималды инвазиялық әдісі. Қол жетімділігі мен бағасы жоғары болғандықтан, 1H-MRS әдісін клиникалық жағдайы мидың креатиндік сарқылуы диагнозын ұсынатын барлық балалар үшін ұсына алмайды.[12]
AGAT жетіспеушілігі - бұл GAMT және креатинді тасымалдаушы ақаумен қатар, креатин биосинтезі / тасымалдау жолының туа біткен үш қатесінің бірі. Бұл ақаулардың таралуы белгісіз, дегенмен олар ақыл-есі кем балаларда жоғары жиілікте байқалды. AGAT-пен байланысты генетикалық мутация а триптофан кодон аялдамаға ауыстырылады кодон 149. қалдық[11]
Жүрек жетімсіздігі
Микроаррай бір есеп бойынша талдау миокард аргининінің айтарлықтай төмендеуін көрсетеді: жүрек жеткіліксіздігінің соңғы сатысында глицин амидинотрансфераза (AGAT) генінің экспрессиясы. Бұл төмендеген АГАТ жүрек қызметінің төмендеуімен корреляциялануы мүмкін екенін көрсетеді. Жүрек жеткіліксіздігінен кейінгі миокардтағы AGAT экспрессиясының креатин синтезінің жоғарылауына байланысты жоғарылауы қолайлы нәтижемен байланысты болды.[13]
Әдебиеттер тізімі
- ^ а б c г. Humm A, Fritsche E, Steinbacher S, Huber R (маусым 1997). «Адамның л-аргининінің кристалдық құрылымы мен механизмі: глицин амидинотрансфераза: креатин биосинтезіне қатысатын митохондриялық фермент». EMBO J. 16 (12): 3373–85. дои:10.1093 / emboj / 16.12.3373. PMC 1169963. PMID 9218780.
- ^ а б c Humm A, Fritsche E, Mann K, Göhl M, Huber R (наурыз 1997). «Адамның L-аргининінің рекомбинантты экспрессиясы мен оқшаулануы: глицин амидинотрансфераза және оның цистеиннің белсенді қалдығын анықтау». Биохимия. Дж. 322 (3): 771–6. дои:10.1042 / bj3220771. PMC 1218254. PMID 9148748.
- ^ Walker JB (1979). «Креатин: биосинтез, реттеу және функция». Adv. Ферментол. Қатынас. Аймақтар Мол. Биол. 50: 177–242. PMID 386719.
- ^ Wyss M, Kaddurah-Daouk R (шілде 2000). «Креатин және креатинин метаболизмі». Физиол. Аян. 80 (3): 1107–213. дои:10.1152 / physrev.2000.80.3.1107. PMID 10893433.
- ^ McGuire DM, Tormanen CD, Segal IS, Van Pilsum JF (ақпан 1980). «Өсу гормоны мен тироксиннің L-аргинин мөлшеріне әсері: гипофизектомизирленген егеуқұйрықтардың бүйректеріндегі глицин амидинотрансфераза. Тышқан бүйрек трансамидиназасының тазалануы және кейбір қасиеттері». Дж.Биол. Хим. 255 (3): 1152–9. PMID 6766137.
- ^ Sipilä I (1980). «Аргинин-глицин амидинотрансферазаның орнитинмен тежелуі. Гипероритинемиямен хороид пен тордың гират атрофиясындағы бұлшықет және хориоретинальды атрофиялардың мүмкін механизмі». Биохим. Биофиз. Акта. 613 (1): 79–84. дои:10.1016/0005-2744(80)90194-1. PMID 7378422.
- ^ McGuire DM, Gross MD, Van Pilsum JF, Towle HC (қазан 1984). «L-аргининді егеуқұйрық бүйрегінің репрессиясы: глицин амидинотрансфераза синтезі креатинмен алдын-ала аудару деңгейінде». Дж.Биол. Хим. 259 (19): 12034–8. PMID 6384218.
- ^ Guthmiller P, Van Pilsum JF, Boen JR, McGuire DM (шілде 1994). «L-аргининді егеуқұйрық бүйрегін клондау және реттілігі: глицин амидинотрансфераза. Өсу гормонымен және креатинмен реттелу механизмін зерттеу». Дж.Биол. Хим. 269 (26): 17556–60. PMID 8021264.
- ^ Криско I, Уолкер Дж.Б. (желтоқсан 1966). «Амидинотрансфераза деңгейіне жыныстық гормондардың әсері. Креатин биосинтезінің метаболикалық бақылауы». Акта эндокринол. 53 (4): 655–62. дои:10.1530 / acta.0.0530655. PMID 5953691.
- ^ Чжу Ю, Эванс М.И. (мамыр 2001). «Эстроген L-аргининнің экспрессиясын модуляциялайды: балапан бауырындағы глицин амидинотрансфераза». Мол. Ұяшық. Биохимия. 221 (1–2): 139–45. дои:10.1023 / A: 1010946414017. PMID 11506177.
- ^ а б CB тармағы, Stöckler-Ipsiroglu S, Stromberger C, Mühl A, Alessandrì MG, Bianchi MC, Tosetti M, Fornai F, Cioni G (қараша 2001). «Аргинин: глицин амидинотрансфераза тапшылығы: адамдардағы креатин метаболизмінің үшінші туа біткен қателігі». Am. Дж. Хум. Генет. 69 (5): 1127–33. дои:10.1086/323765. PMC 1274356. PMID 11555793.
- ^ Carducci C, Birarelli M, Leuzzi V, Carducci C, Battini R, Cioni G, Antonozzi I (қазан 2002). «Физиологиялық сұйықтықтардағы гуанидиноацетат пен креатин мен креатининді бағалау: аргинин биохимиялық диагностикасының тиімді диагностикалық құралы: глицин амидинотрансфераза және гуанидиноацетат метилтрансфераза тапшылығы». Клиника. Хим. 48 (10): 1772–8. PMID 12324495.
- ^ Каллен М.Е., Юен А.Х., Фелкин Л.Е., Смоленский Р.Т., Холл Дж.Л., Гриндл С, Миллер Л.В., Биркс Э.Дж., Якуб МХ, Бартон П.Ж. (шілде 2006). «Аргининнің миокардтық экспрессиясы: глицин амидинотрансфераза гені жүрек жеткіліксіздігінде жоғарылайды және қалпына келгеннен кейін қалыпқа келеді: жергілікті креатин синтезіне потенциалды салдары». Таралым. 114 (1 қосымша): I16–20. дои:10.1161 / АЙНАЛЫМАХА.105.000448. PMID 16820567.
