Aza-Cope қайта құру - Aza-Cope rearrangement - Wikipedia
Қайта құру, әсіресе қатыса алатындар каскадты реакциялар, сияқты aza-Cope қайта құрылымдары, жоғары практикалық, сондай-ақ тұжырымдамалық маңызы бар органикалық химия, қарапайым бастапқы материалдардан құрылымдық күрделілікті тез құра алатындығына байланысты. Аза-Копты қайта құру - бұл гетероатомдық нұсқалардың мысалдары Қайта ұйымдастыруды жеңу, бұл [3,3] -сигматропты қайта құру бір және екі байланыстарды екеуінің арасында ауыстырады аллилді компоненттер. Вудворд-Гофман ережелеріне сәйкес, термиялық аза-Копты қайта құру бет үсті бойынша жүреді.[1] Aza-Cope қайта құрылымдары, әдетте, азоттың молекуладағы орны бойынша жіктеледі (суретті қараңыз):

Аза-Копты қайта құрудың алғашқы мысалы барлық жерде болды катионды 2-аза-Cope қайта құрылымдау, бұл қайта құрылымдаудың физикалық сипатына байланысты Cope қайта құрылымдауынан 100-200 ° C төмен температурада орын алады.[2] Бұл қайта құрылымдаудың табиғаты катиондық 2-аза-Коуптің термоядролық екендігімен де байланысты, яғни бастапқы материалға немесе өнімге ешқандай қателік болмайды, сонымен қатар молекуладағы зарядталған гетероатом, бұл активтендіру кедергісін төмендетеді. Аз таралған 1-aza-Cope қайта құрылымдау және 3-aza-Cope қайта құру, олар бір-біріне микроскопиялық кері болып табылады. 1- және 3-aza-Cope қайта құрылымдаудың активтену кедергілері жоғары және синтетикалық қолданылуы шектеулі, бұл олардың салыстырмалы қараңғылығын ескереді.[3][4][5]
Өзінің синтетикалық пайдалылығын арттыру үшін катиондық 2-аза-Коптың қайта құрылымы, әдетте, қайта құрылымдаудың бір жағына қарай термодинамикалық ығысумен жұптасады. Ең көп таралған және синтетикалық пайдалы стратегия жұпты катионды 2-аза-Cope манних циклизациясымен қайта құру, және осы мақаланың көп бөлігі. Бұл аза-Коп / Маннич тандемі реакцияның жеңіл шарттарымен, диастереоэлектрлігімен және кең синтетикалық қолданылуымен сипатталады. Бұл ацил-алмастырылғанға оңай қол жеткізуді қамтамасыз етеді пирролидиндер, сияқты табиғи өнімдерде кездесетін құрылым алкалоидтар, және олардың бірқатарының, атап айтқанда стрихнин мен крининнің синтезінде қолданылған.[6] Ларри Э. Овермен және әріптестер бұл реакция туралы кең зерттеулер жүргізді.[1]
Катиондық 2-аза-Cope қайта құрылымы

Катиондық 2-аза-Cope қайта құру, ең дұрыс деп аталатын 2-азония- [3,3] -сигматропты қайта құрылымдауды Ларри Э. Овермен және оның әріптестері мұқият зерттеді. Бұл құрылымды жүзеге асыру үшін қажет болатын жұмсақ жағдайларға, сондай-ақ алкалоид синтезінде көптеген синтетикалық қосымшаларға байланысты аза-Cope қайта құрылымдары туралы ең кең зерттелген. Термодинамикалық тұрғыдан алғанда, жалпы 2-аза-Коптің қайта құрылымдауында өнімнің ығысуы болмайды, өйткені үзілген және түзілген байланыстар Cope қайта түзілуіне ұқсас реакцияның кез-келген бағытында эквивалентті болады. Иондық азоттың гетероатомының болуы катионды 2-aza-Cope қайта құрылымының беткі қабатын қайта құру Cope қайта құрылымдауымен салыстырғанда. Демек, ол көбінесе а-мен жұптасады термодинамикалық раковина қайта құру өнімін біржақты ету.[1]
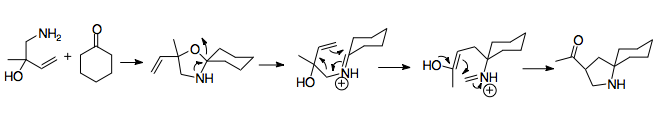
1950 жылы Хоровиц пен Гейсман 2-аза-Копты қайта құрудың алғашқы мысалы туралы хабарлады, бұл синтездеудің сәтсіз әрекеті үшін таңқаларлық нәтиже амин спирті.[2] Бұл жаңалық қайта құрылымдаудың негізгі механизмін анықтады, өйткені өнім Cope қайта құрылымдауының азотты аналогы арқылы шығарылған. Аллилбензиламинді (А) құмырсқа қышқылымен және формальдегидпен емдеу амин спиртіне (В) әкеледі. Амино спирт қышқыл (С) қосқанда иминге айналады, ол катиондық 2-аза-Коуп қайта құрудан (D) өтеді. Су иминиум ионын аминге (E) дейін гидролиздейді. Осы бастапқы затты тек формальдегидпен өңдеу амин тобының алкилдеуі катионды 2-аза-Коуп қайта түзілуінен кейін болғанын көрсетті, бұл қайта құрудың тез құрылуының дәлелі.[2]

Жүргізілген реакцияның жұмсақ қыздыру жағдайларына байланысты, таза көмірсутектерді қайта құрудың қатаң режимдерінен айырмашылығы, бұл гетероатомдық Cope қайта құру гипотезаны енгізді, бұл азотқа оң зарядтың қайта реттелуі активация кедергісін айтарлықтай төмендетеді қайта құру.[2]
Реакция механизмі
Оң зарядталған азоттың әсерінен жылдамдықтың үдеуі

Аза-Cope қайта құрылымдауын болжамдайды Вудворд-Гофман ережелері үстіңгі бетпен жүру. Алайда, ешқашан нақты зерттелмегенімен, Овермен мен оның әріптестері гипотеза жасады, бұл катализаторлар сияқты oxy-Cope қайта құру, зарядталған атом оң зарядты аллилдік фрагментке делолизациялауына байланысты сигматропты қайта құруды таза келісілген реакция механизмінен (Cope қайта құрылымдауында күткендей) ішінара дирадикалды / диполярлы сипатқа бұрмалайды, бұл аллилдік байланысты әлсіретеді. Бұл байланыстың үзілуіне арналған белсендіру тосқауылының төмендеуіне әкеледі. Осылайша, катионды-аза-Cope қайта құруы Cope қайта құрылымдау сияқты келісілген процестерге қарағанда тез жүреді.[6][7]
Өтпелі күй және стереохимия
Катионды 2-aza-Cope қайта құрылымдау жоғары стереоспецификалықтығымен ерекшеленеді, бұл оның креслоларға ауысу жағдайына деген жоғары ықыласынан туындайды. Овермен және оның әріптестері осы қайта құрылымдаудың стереоспецификасын зерттеу барысында классикалық Doering және Roth эксперименттеріне ұқсас логиканы қолданды,[8] бұл Cope қайта құру креслолардың конформациясын қалайтындығын көрсетті.[9] Пирролизидиннің прекурсорларына катиондық 2-аза-Коуп / Маннич реакциясын қолдана отырып, олар Е-алкендерден цис алмастырғыштармен және Z-алкендерден транс орынбасарлармен пирролизидиндердің көп қолданылатындығын көрсетті, бұл креслолардың ауыспалы күйін көрсетеді. Егер қайықтардың ауысу жағдайы жедел болса, керісінше нәтижелер шығар еді (төмендегі суретте толығырақ).[9] Көптеген реакциялардың тенденциясы сияқты, Z-энолаттың конверсиясы энолят пен сақина арасындағы 1,3 диаксиалды стерикалық өзара әрекеттесуге, сондай-ақ орынбасарлардың квази-экваторлық позицияны қалайтындығына байланысты төменгі селективтілік береді. Бұл Z-энолатты конверсиялау үшін қажет жоғары температураны түсіндіруге көмектеседі.[6][9]Қайықтың ауысу күйі катиондық-2-аза-Коптың қайта құрылымдауымен Cope қайта құрылымдауына қарағанда онша қолайлы емес: Cope қайта құрылымдауының қайыққа ауысу күйін қабылдаған ұқсас жағдайларда, аза-Cope қайта құрылымы орындықта жалғасады геометрия.[1][6][10] Бұл нәтижелер есептеу химиясының нәтижелерімен сәйкес келеді, әрі қарай олар өтпелі күй кинетикалық бақылауда болады деп тұжырымдайды.[11]

Бұл стереохимиялық эксперименттер катиондық 2-аза-Коптың қайта құрылуы (сонымен қатар Маннич циклизациясы) энол немесе иминиум таутомеризациясына қарағанда тез жүретіндігін білдіреді. Егер олар болмаса, ешқандай жылдам стереохимия байқалмас еді, бұл жылдам реакцияның құралын көрсетеді.[1]
Стереохимия туралы қосымша ойлар
Қатысқан кезде аза-Коуп / Маннич реакциясы сақинаны кеңейтетін аннциялар, ең қолайлы креслолардың конформациясы бойынша стереохимияға сүйенеді, бұл көбінесе эквивалентті мөлшерде үлкен алмастырғыштарды орналастырады. Винил мен амин компоненттері сақинаға орнатылған кезде син және анти қатынастарға ие болуы мүмкін. Бұл қатынасты әдетте амин орнын басқыш белгілейді: үлкен алмастырғыштар син аза-Cope прекурсорларына әкеледі. Әзірге қарсы винил мен аминді алмастырғыштар әдетте бір қолайлы өтпелі күйге ие, бұл цис балқытылған сақина жүйесіне әкеледі, син алмастырғыштардың қолайлы өнімі өзгеруі мүмкін, еріткіштермен немесе ірі N-орынбасарлармен стерикалық өзара әрекеттесуі, ал олар үлкен көлемді алмастырғыштардан гөрі басымдық алуы мүмкін өтпелі мемлекет.[12][13]
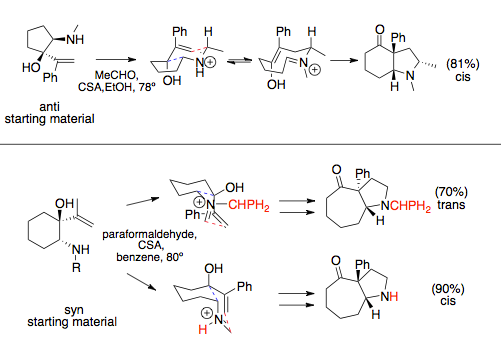
Қарапайым аза-Коуп / Маннич реакцияларында сақинаның кеңеюіне қатыспайды, яғни амин спирттері мен эфирлерінің конденсациялары, байланыстың айналуы Маннич циклизациясына қарағанда тез жүреді және рацемиялық өнімдер байқалады.[14] Аминдегі хирал қосалқы алмастырғышты қолдану арқылы бұны болдырмауға болады. Сақиналарға байланған реакциялар бұл байланыс айналуларынан өте алмайды.[1]

Өнімді қайта құру үшін термодинамикалық раковиналар болуы мүмкін
Хоровиц пен Гейсманның алғашқы мысалы катионды 2-аза-Коптың қайта құрылуымен жұптасуға болатын термодинамикалық раковинаны көрсетеді, мұнда өнім арил конъюгациясы арқылы фенил алмастырғышқа итермелейді, содан кейін иминиум гидролизімен ұсталады. Өнімді бейтараптандырудың басқа әдістеріне алмастырылған көміртектерде орнықтырғыштарды қолдану, сақиналық штаммды босату (мысалы, циклопропанның ашылуымен қайта құруды жұптастыру арқылы), молекулааралық ұстау (суретте) және қайта құрылымдауды Маннич циклизациясымен жұптастыру.[1][15]

Аза-Коп / Маннич реакциясы
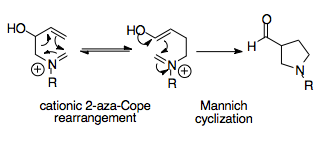
Аза-Коп / Маннич реакциясы синтетикалық қуатты реакция болып табылады, өйткені ол қарапайым бастапқы материалдардан күрделі циклдік молекулаларды құруға қабілетті. Бұл тандемдік реакция бір қайта құру өніміне термодинамикалық бейімділікті қамтамасыз етеді, өйткені Маннич циклизациясы қайтымсыз және оның өнімі - ацилмен ауыстырылған пирролидин сақина, қайта құруға қарағанда тұрақты.[1][16]
Бірінші аза-Коп / Маннич реакциясы
Овермен және оның әріптестері катиондық 2-aza-Cope қайта құруы, егер тиісті термодинамикалық раковина енгізілсе, синтетикалық тұрғыдан қуатты болатынын мойындады. Олардың логикасы бастапқы материалға нуклеофильді алмастырғышты, яғни алкоголь тобын қосу, ол тек қайта құрылғаннан кейін әрекет ететін, enol иминиум ионына шабуыл жасауға дайын.
Бұл реакция туралы алғашқы есеп альдегидтер мен 2-алкокси-3-бутенаминдер арасындағы реакция болды, олар аза-Коп / Маннич реакциясы өнімі ацилмен алмастырылған пирролидин сақинасы болған аминқышқылын түзді. Бұл қарапайым процедура бірнеше сағат ішінде жұмсақ қыздыруды ғана қамтыды. Маңыздысы, аза-Коп / Маннич реакциясы бір қадамда керемет кірістілікпен жүреді. Бұл процедура аминқышқылдардың конденсациясына оңай қолданылады (төменде көрсетілген), мұнда алкоголь алдымен метилденген.[16] Аза-Коп / Маннич реакциясы жүргізілгеннен кейін кетон NaOH қосу арқылы түзіледі.[16] Амин, қарапайым жағдайда иминиум ионын негізгі кетондардан түзе алмайды; кейінгі әдістер реакцияларға кетондарды қосу тәсілдерін тапты.[16][17] Бұл реакцияның пайдалылығы, онша тұрақты емес изомер түзілген кезде де, реакция өзінің жоғары термодинамикалық қолайлығын көрсете отырып жүретіндігінде айқын көрінеді.[12][17]

Реакция механизмі

Реакцияның жалпы өнімі екі бөлек жол арқылы жүруі мүмкін: аза-Коп / Маннич реакциясы немесе аза-Принс циклизациясы /.пинаколды қайта құру. Бұл механизмдердің аза-Коп / Маннич реакциясының үстемдігін анықтайтын әр түрлі стереохимиялық қасиеттері бар. Аза-Коп / Маннич реакциясы [1,5] диен аналогындағы әрбір атомды sp2 будандастыру, бастапқы заттың стереохимиясын R 'күйінде өшіру, ал аза-Принс / пинаколды қайта құру стереохимияны R' күйінде ұстап, белсенді механизмді көрсететін қарапайым тестке нұсқау. «R '» позициясындағы энантиомериялық тұрғыдан таза бастапқы зат рацемиялық өнімге әкелуі керек, егер басым механизм аза-Коп / Маннич реакциясы болса, стереохимия аза-Принс циклизациясы / пинаколды қайта құру болған жағдайда сақталуы керек. жол. Қарапайым эксперимент өнімнің рацемиялық екенін растады, бұл оперативті механизм ретінде аза-Коуп Маннич реакциясының айқын дәлелі болды. Әрі қарай эксперименттер аза-Принс / пинакол жолында пайда болған карбениум ионы оның орынбасарының оң зарядты тұрақтандыру қабілетімен жүретіндігін біліп, сол арқылы жолдың реактивтілігін өзгертті. Алайда әр түрлі орынбасарлардың реакция нәтижесіне әсері аз болып, қайтадан оперативті механизм ретінде аза-Коуп Манних реакциясын көрсетті.[14]Шанахан зертханасынан алынған соңғы әдебиеттер сирек кездесетін аза-Принс / пинакол жолын тек алкеннің нуклеофильділігі мен иминиум электрофилдігінің едәуір жоғарылауымен байланыстырады.[1][6][18][19]
Аза-Коп / Маннич реакциясы, әдетте, нәтижелеріне сәйкес жоғары диастереоэлектрлікті көрсетеді катиондық 2-аза-Коптың қайта орналасуының өтпелі күйін анықтайтын стереохимиялық тәжірибелер Осы реакцияның тандемдік жолы осы эксперименттердің ажырамас бөлігі болды. Қайта құрудың стереохимиясы сәл күрделенген аллил мен амин алмастырғыштар сақинаға орнатылады, сөйтіп бір-біріне ауысады.
Аза-Коп / Маннич реакциясының бастапқы материалы - амин спиртін де байланысты деп санауға болады oxy-Cope қайта құру (төменде), иондық қатысу әсерінен жылдамдықтың үдеуі үшін де, Маннич циклдануындағы энолдың ыдырайтын аналогтық функциясы және окси-Копты қайта құрудағы кето-энол таутомеризациясы үшін де.[7]

2-аза-Коп / Маннич реакциясының синтетикалық қосымшалары
Аза-Коп / Маннич реакциясы көбінесе синтездеудің ең тиімді әдісі болып табылады пирролидин табиғи өнімнің жалпы синтезінде бірқатар қосымшалар бар. Диастереоэлектрлік болғандықтан, бұл реакция асимметриялық синтездеу құралдарының каталогына қосылды, бұл көптеген асимметриялық мысалдардан көрінеді алкалоидтар реакцияны қолдану арқылы синтезделеді. Біз көргендей бірінші аза-Коп / Маннич реакциясы және реакцияның түсіндірілуінде стереохимия, қалыптастыру үшін aza-Cope / Mannich реакциясын қолдануға болады пирролидин сақиналар және пирролизидин сақиналар. Оның көмегімен синтезде пайдалы көптеген қосымша сақиналық құрылымдар жасауға болады индолизидин циклдары және индол сақиналар.[1][7]
(-) - стрихниннің жалпы синтезі
Бұл реакцияның пайдалылығын көрсететін классикалық мысал - стрихниннің Овермен синтезі. Стрихнин табиғи түрде кездесетін өте улы алкалоид, бұтада және өрмелеу бұтасында кездеседі Стрихнос. Стрихнин әдетте кішкентай омыртқалы пестицид ретінде қолданылады. Ең бірінші стрихниннің жалпы синтезі, В.Будвордтың,[20] табиғи өнімді синтездеудегі маңызды қадам болды: оның күрделілігіне жақындаған бірде-бір молекула бұрын синтезделмеген болатын. Келесі жалпы синтездер туралы 1980-ші жылдардың аяғына дейін, ұқсас әдістерді, атап айтқанда деградацияланған стрихнинмен қол жетімді аралықты қолдану арқылы хабарлаған жоқ. Бұл синтездердің барлығы қатал жағдайларды қолданды. Овермен синтезі бұл мәселелерді шешпейді және аза-Коп / Маннич реакциясының диастереоэлектрлік және жеңіл реакция жағдайларын пайдаланып, стрихниннің алғашқы асимметриялық жалпы синтезі болып табылады. Аза-Коп / Маннич реакциясы қадамы сандық өнімділікке жақын болды. Овермен синтезі, сәйкесінше, күштің бірнеше реттері алдыңғы деңгейлерге қарағанда тиімдірек.[20]

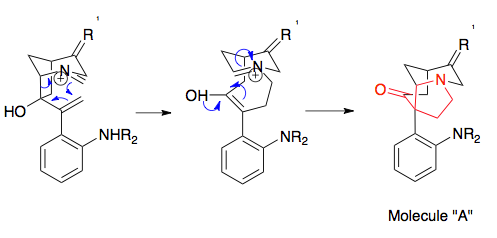
Сверхниннің овермен синтезі аза-Коп / Манничті қайта құруға қажетті прекурсорларды дайындаудың пайдалы мысалы болып табылады, бұл эпоксидті сақинаның ашылуы. Аза-Коп / Маннич реакциясы үшін қажетті бастапқы материалдарға әкелетін қайта құру субстратының синтезінің негізгі кезеңдеріне Стил реакциясы екі прекурсорды біріктіру, қос байланыстың эпоксидтелуі кірді терт-бутил гидропероксиді, а Виттиг реакциясы кетонды алкенге айналдыру және циклдану сатысы. Амин алкилдеуі (көрсетілмеген), молекуланы қайта құрылымдау субстратына айналдырады. Бұл молекула аза-Коп / Маннич реакциясының энантиомерлік дәлдігін көрсетеді, өйткені қарапайым энантиомерлік бастапқы материал соңғы энантиомерді белгілейді: стрихниннің энантиомері бастапқы материалдың энантиомерін қолдану арқылы алынған.[20][21]

Овермен синтезі, қайта құру субстратының синтезінің егжей-тегжейімен, сондай-ақ реакцияның соңғы кезеңдерімен егжей-тегжейлі баяндалған: (-) - стрихниннің супермен синтезі.
(-) - крининнің синтезі
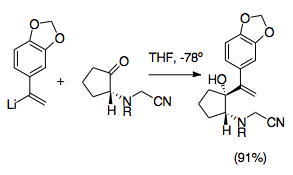
Кринин отбасының алкалоиды болып табылады Амариллидалар, және оның асимметриялық жалпы синтезі аза-Коп / Маннич реакциясын қолданғандардың алғашқыларының бірі болды. Бұл синтез аза-Коп / Маннич реакциясының дамуындағы маңызды қадамды білдіреді, өйткені ол реакцияға тән бірнеше пайдалы синтетикалық стратегияларды пайдаланады. Бұл реакция катионды-2-аза-Коптың қайта орналасуының жоғары диастереоэлективтілігін, сондай-ақ цианометил тобы кезінде аминді қорғау виниллитий қосу және иминиумның қалыптасуына ықпал ету үшін кететін топ ретінде, қосудың көмегімен жүзеге асырылады күміс нитраты.[22]Бұл синтез көптеген мысалдардың бірі болып табылады цианометил тобы пирролидин мен индолизидин түзілуіне синтетикалық жағынан пайдалы жолды қамтамасыз ету.

Көпірлі үшциклді алкалоидтардың синтезі
Овермен мен әріптестер аза-Коуп / Маннич реакциясын қолдана отырып, күрделі көпіршікті трициклдық құрылымдарды синтездеу әдістерін жасады. Бұл аза-трициклді құрылымдар кешенде кездеседі Стемона алкалоидтар отбасы, сондай-ақ кейбіреулері сияқты потенциалды препараттарда иммуносупрессанттар. Көрсетілген мысал 1-аза-бицикло [2.2.1] гептан тұзының бастапқы материалымен параформальдегидті 80 ° C температурада біріктіріп, аза-трициклдік құрылымды қалыптастыру Стемона алкалоид молекулалары. Бұл сақиналық жүйенің стериктерінің әсерінен орбиталық қабаттасудың қолайсыздығына қарамастан, реакция 94% кірістілікпен жүреді, бұл тіпті қолайсыз жағдайларда да реакцияның күшін көрсетеді.[23]
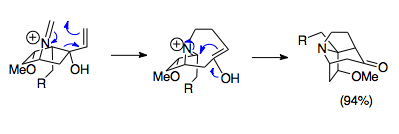
Жалпы сақинаны ашу және кеңейту

Аза-Коуп / Маннич реакциясы көбінесе қолданыстағы сақиналық циклдармен бірге қолданылады индолизидин циклдар (цирлогиден сақинасына қосылған пирролидин). Бұл әдеттегі сақина аннотация, мұнда циклопентан бөлігі қайта құрумен ашылып, Маннич циклизациясымен жабылып, пирролидин сақинасына бекітілген алты мүшелі сақина түзіледі, ал ең танымал аза-Коп / Маннич ануляциясы бұл жалғыз емес. Жеті мүшелі сақиналық циклдарды синтездеуге де болады, өйткені энол мен иминиум иондары Маннич циклизациясынан өтетіндей жақын орналасқан.[22] Макроцикл синтезі энол мен иминиумның жақындығының болмауына байланысты осы реакцияны қолдану туралы хабарланған жоқ.[6]Винил оксазолидиндері қайта құрылымдау субстраттары ретінде де қолданыла алады. Бұл қайта құру алдымен жасайды аминобутенол арқылы циклогексанонға шабуыл жасайтын винилоксазолидин, содан кейін аза-Коуп / Маннич реакциясы арқылы жылу мен қышқылды қолданады (Льюис немесе протик). Бұл мысал үзіліп, содан кейін бес мүшелі сақинаны құрайды. Оксазолидинді неғұрлым күрделі мысалдар индолидидин циклдарын қалыптастырудың қосымша әдістерін ұсына отырып, басқа сақинаға бекітеді.[24]
Аза-Коп / Маннич реакциясы аясы
Аза-Коп / Маннич реакциясы басқа әдістермен салыстырғанда көптеген артықшылықтарға ие. Реакцияның нәзік шарттары сәйкес келмейді: әдетте 80 ° C-тан аспайтын жеңіл қыздыру, еріткіштердің кең спектрі және 1 стехиометриялық эквивалентті қышқыл қосу, әдетте Камфорсульфон қышқылы (CSA) немесе Льюис қышқылы. Пирролидин синтезіне басқа бағыттар стереоспецификамен бәсекеге түсе алмайды, құрамында пирролидин туындылары бар құрылымдарда кең ауқымды қолдану және мүмкін бастапқы материалдардың ауқымы. Реакция экспонаттары жоғары диастереоэлектрлік, және сенімді, жалғасуда өтпелі күйде нашар орбиталық қабаттасуға тап болған кезде де.[1]

Аза-Коп / Маннич реакциясының артықшылығы реакцияның бастапқы материалдарын синтездеу бойынша зерттеулер жүргізуге түрткі болды, олар екі негізгі категорияға бөлінді: амин қоспасы және иминиум түзілуі (қызыл) және винил алмастырғышты орнату (көк). Реакцияда N-алмастырғыштардың (R), алкил мен арилдің алуан түрін қолдануға болады, олардың кейбіреулері стереохимиялық нәтиже реакция. Винил топтары, әдетте, 1,1 немесе 1,2-дәнекерленген топтармен шектеледі (R-да орынбасарлары бар винил)1және Р.1, R2 электронды және стерикалық әртүрліліктің кең спектрімен.[1]
Аминді қосу және иминиумның түзілуі
Эпоксидті сақинаның ашылуы
Эпоксидтердің сақиналық штамы алкоголь тобынан амин атомдарының екі атомын орнатудың пайдалы әдістемесін ұсынады. Эпоксид алдымен бромды нуклеофильді шабуылмен бұзылуы мүмкін. Бастапқы аминдер, хош иісті аминдер немесе литий анилидтері нуклеофилдер ретінде де қолданыла алады. Қорғаушы О-метиляция бұл қадамды жиі орындайды және оңай жүреді.

Стериктер тек тиісті көміртекке шабуыл жасауға мүмкіндік бергенде (екінші көміртекке қарағанда терминалды көміртек), молекулаішілік азоттың тікелей шабуылы тиімді, мысалы, стрихнин синтезі.[16][25]
Иминиум ионының түзілуі
Орнатылған аминнен иминиум ионын алудың ең кең тараған тәсілі - қосу формальдегид немесе параформальдегид, ол қышқыл-катализденеді конденсация иминиум қалыптастыру. Оверменнің стрихнин синтезі осы әдісті анықтайды.[6][25] Кейде молекулааралық карбонилдер қолданылады.[9] Иминиум ионын түзудің басқа әдістеріне қолдану жатады цианометил топтары немесе пайдалану карбонил прекурсорлары ретінде оксазолидиндер.

Амин алкилдеуі
Амин алкилдеу иминнің прекурсорларына жетудің кең тараған әдісін ұсынады. Аминді алкилдеу тікелей S арқылы жүредіN2 реакциясы аминдердің асалькилатқа бейімділігінің жоғары болуына байланысты бастапқы материалдарды өндіруде кейде пайдалы болады.[25]Редуктивті аминация - кең таралған және тиімді алкилдеу процедурасы, бірінші аза-Cope қайта құрылымдауында типтелген.[16][26][27]Аминді алкилдеудің ең пайдалы және стандартты әдісі - аминнің амидтік байланыс түзуі және кейіннен оны көбінесе LiAlH4.[9]
Оксазолидинді қолдану
Кетондар мен стерикалық кедергідегі альдегидтер негізгі аза-Коп / Маннич реакциясы үшін жарамайды, өйткені амин олармен иминиум ионын құра алмайды. Сусыздандырғыш оксазолин түзілуі, содан кейін қышқылдың толық эквиваленті болған кезде қыздыру осы мәселені шешудің жолын ұсынады.Оверман реакция үшін иминиум ионын алу үшін окизолидиндер қолданғанын хабарлады. Пайда болған кезде Овермен пирролидин синтезіндегі карбонил компоненті үшін циклогексанондарды қолдануға болатындығын көрсетті.[17] Бұл реакция циклогексанондардың әртүрлі формаларымен жүрді. Ациклді кетонды алмастырған кезде реакция төмен кірістілікпен жүрді, циклогексанонды қос байланысқан карбонилден босатудың термодинамикалық жағымдылығын көрсетті, өйткені ол орындық конформында қолайсыз байланыс штаммын тудырады. Бұл пайдалы табиғи өнім болып табылатын 1-азаспиро [4,5] декан сақина жүйесінің ыңғайлы құрылымдарының бірін білдіреді.[17]
Винилді алмастырғышты орнату
Кетондарды винилдеу
Виниляция реакцияның кеңейтілген функционалдығына мүмкіндік беретін қосымша синтетикалық артықшылықтар ұсына алады.[23] Органолитий реактивтері әдетте қолданылады. Көбінесе азоттың орнына орынбасушы немесе қорғайтын топ қосылады, бірақ бұл әрдайым қажет емес. Литийдің реакцияға қосылуы бастапқы зат стереохимиясына үлкен әсер етеді, өйткені азот оған координат жасайды. Осы үйлестіру әсер ететін бастапқы материалдар, әдетте, аза-Копқа қарсы прекурсорларды тудырады, ал ондай емес, мысалы, құрамында жоғары алмастырылған, құрамында стерикалық кедергісі бар аминдер, синекурстарға әкеледі. Осылайша азотты алмастырғыштың табиғаты өте маңызды.[6][25]
Цианометил тобын қолдану
Цианометил топтары кетонды аллилді винилдеу кезінде иминиум ионын қорғаудың қарапайым әдісін ұсынады. Цианамид топтары мен аналогтары иминиум иондарының буынында жиі қолданылған. Әдетте олар иминиум ионына нуклеофильді қосылу арқылы орнатылады, әдетте формальдегидпен амин алкилдеуі нәтижесінде пайда болады. Иминиум ионы маскирленеді.[28] Цианометил тобын қолдану аза-Коп / Маннич реакциясын басқарудың тиімді әдісін ұсынады. Цианометил тобы азотты цилиндр типіне ұқсас басқа аллиликалық аналогты қалыптастыру кезінде 2-позицияда қорғайды. Умполунг. Одан кейін иминиум ионын түзуде оны иминиум ионының пайда болуына сәйкес қалыптастыру үшін жақсы кету тобы қамтамасыз етіледі.[29] Цианометил топтарынан иминиум ионының түзілуі, әдетте күміс және мыс қоспалары қолданылғанымен, күміс нитратының қосылуымен жүреді. Бұл қосымша қадам иминиум иондарының түзілуін дәлірек басқаруға мүмкіндік береді.[6][29] Маңыздысы, бұл дайындық реакциялары цианометил / виниллитийдің өзара әрекеттесуін болдырмау үшін -78 ° C температурада жүргізілуі керек. Бұл әдіс сонымен қатар көптеген әр түрлі мүмкін N-алмастырғыштарға мүмкіндік береді және октагидриндолдар синтезін жеңілдету үшін қолданыла алады. пиролдар.[1][29]

1 және 3-aza-Cope қайта құрылымдары

1- және 3-aza-Cope қайта құрылымдары катиондық 2-аза-Коптың қайта орналасуына қарағанда салыстырмалы түрде жоғары болатын активация энергияларына байланысты катиондық 2-аза-Коп қайта құрылымына қарағанда түсініксіз.
1- және 3-aza-Cope эминнің түзілуіне қарағанда имин түзілуіне бейімділікке ие, өйткені көміртек-азот π байланысы көміртегі-азот σ-байланысына қарағанда күшті, яғни 3-аза-копаның қайта орналасуы термодинамикалық тұрғыдан қолайлы, ал 1-аза-Коуптің қайта құрылуы онша емес: иминнің энергиясы 10 ккал / мольға аз. Осылайша, 3-aza Cope активациясының үлкен кедергілері кинетикалық тұрғыдан негізделген.[30] 1 және 3-aza-Cope қайта құрылымдауындағы зерттеулер активтендіру кедергілерін төмендету үшін жақсы қозғаушы күштерді табуға бағытталған. Бұл қайта құрылымдаудың бірнеше нұсқалары синтетикалық утилиталар үшін оңтайландырылған. 1-aza-Cope қайта құрылымы әдетте термодинамикалық қозғаушы күштермен жұптасқан. 3-aza-Cope қайта құруы кинетикалық тосқауылды оның термодинамикалық тиімді өніміне төмендету үшін катионды түрде орындалады.[30][31]
Бұл қайта құрылымдау көптеген жағдайларға сәйкес келеді катиондық 2-Aza-Cope қайта құрудың механикалық логикасы. 1- және 3-aza-Cope қайта құрылымдаулары орындықтың ауысу жағдайлары арқылы жүзеге асады (және стереохимияны сақтайды, катиондық 2-aza-Cope қайта құрылымына ұқсас) және оң зарядты енгізумен жеделдетті, өйткені бұл өтпелі күйге дирадикалды / диполярлық сипат береді.[31] 3-aza-Cope қайта құрылымы (сонымен, сол өтпелі күйден өтетін 1-aza-Cope қайта құрылымы) Cope қайта құрылымы мен катионды-2- мен салыстырғанда өтпелі күйінде тіпті аз хош иісті сипат көрсетеді деп күтілуде. осы келісімдер үшін кинетикалық активтендіру кедергілерін еңсеру үшін қажетті температураның жоғарылауына ықпал ете отырып, аза-Cope қайта құруы (Cope Rangerangement үшін қажет температураға жақын, кейде одан да жоғары, 170-тен 300 градусқа дейін).[3][31][32]
3-aza-Cope қайта құрылымдау

3-aza-Cope реакциясы 2-aza-Cope қайта түзілуі анықталғаннан кейін көп ұзамай табылды, бұл Клайзеннің қайта құрылымдауымен ұқсас байланысына байланысты болды. Шынында да, алғашқы құжаттарда аза-Копты қайта құрудың бұл нұсқасы көбінесе амино-Клазенді қайта құру деп аталады, бұл қайта құрылымдау туралы дұрыс емес мәлімет, өйткені бұл азоттың да, оттектің де молекулада болатындығын білдіреді.[3] Бұл қайта құрылымды көміртегі, көбінесе пиперидинмен байланысты гетероциклдік сақиналарды қалыптастыру үшін қолдануға болады.
Бұл келісімнің алғашқы мысалдарының бірін Бурпит анықтады, ол аммоний тұздарында болатын қайта құруды мойындады, олар зарядталған табиғатына байланысты жылу қоспай экзотермиялық жолмен жүрді, ең бастысы, тетрасубарланған азотсыз қайта құру жалғасқан жоқ.[33] Осы қисынға сүйене отырып, 3-aza-Cope қайта құрылымдау бойынша зерттеулердің көп бөлігі осы реакцияның зарядталған цвитериондық нұсқаларына бағытталған, өйткені зарядтың таралуы активациялау тосқауылын төмендетуге көмектеседі: белгілі бір жағдайларда қайта реттеу төмен температурада орын алуы мүмкін - 20 ° C.[30][34]

HIll және Gilman алғаш рет 1967 жылы 3-аза-копаның қайта зарядталмағандығы туралы хабарлады. Сәйкесінше алмастырылған эминдер пайда болғаннан кейін, қатты қыздыру иминдік өнімге толықтай дерлік қайта құруға мүмкіндік берді. However, this rearrangement pathway has limited utility.[35]
The 1-aza-Cope rearrangement

The first discovered 1-aza-Cope reaction was a simple analog to the generic Cope reaction and required intense heat to overcome its large thermodynamic activation barrier; most subsequent work on the 1-aza-Cope rearrangement has thus focused on pairing the arrangement with a driving thermodynamic force to avoid these harsh reaction conditions. It has been hypothesized that the 1-aza-Cope rearrangement rate-determining transition state has partial diradical and dipolar transition state character due to the presence of the heteroatom.[4]
Fowler and coworkers have come up with a scheme that mobilizes the 1-aza-Cope rearrangement as a synthetically useful route.[3] Fowler and coworkers recognized that because the barrier for the reaction lies in the nitrogen's thermodynamic preference to stay as an imine, stabilizing the nitrogen could have a thermodynamically beneficial effect. To that end, Fowler and coworkers installed a carbonyl group on the nitrogen, hypothesizing that the lone pair of the nitrogen would be stabilized by participation in an amide bond, and that the electronegativity of this amide group would lower the LUMO of the imine group, making the transition state more favorable.[3] Using this strategy, Fowler and coworkers were able to use the 1-aza-Cope rearrangement to create пиперидин және пиридин туындылар. This strategy was shown to be relatively robust, allowing for the formation of products even when forced through a boat transition state, when perturbed with substituent effects, or put in competition with alternative rearrangements.[3] Also significant is the relative ease of production of the reactants, which uses a Diels-Alder reaction paired with relatively simple workup steps, allowing for syntheses using complex cycling.[3]
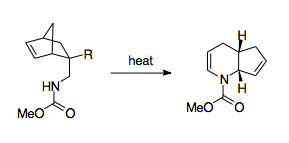
Other methods of overcoming this thermodynamic barrier include pairing it with cyclopropane ring strain release, which allows the reaction to proceed at much lower temperatures.[30][36]

Сондай-ақ қараңыз
- Reviews by Overman[1][37] және Siegfried Blechert.[38]
Әдебиеттер тізімі
- ^ а б c г. e f ж сағ мен j к л м n Overman, L. E.; Humphreys, P. G.; Welmaker, G. S. (2011). "The Aza-Cope/Mannich Reaction". Органикалық реакциялар. 75. pp. 747–820. дои:10.1002/0471264180.or075.04. ISBN 978-0471264187.
- ^ а б c г. Horowitz, R. M.; Geissman, T. A. (1950). "A Cleavage Reaction of α-Allylbenzylamines". Дж. Хим. Soc. 72 (4): 1518–1522. дои:10.1021/ja01160a025.
- ^ а б c г. e f ж Chu M.; Wu P.L.; Givre S.; Fowler F.W. (1986). "The 1-AZA-Cope rearrangement". Тетраэдр хаттары. 27 (4): 461–464. дои:10.1016/S0040-4039(00)85505-7.
- ^ а б Wu, P.L; Fowler, F. W. (1988). "The 1-aza-Cope rearrangement. 2". Органикалық химия журналы. 53 (26): 5998–6005. дои:10.1021/jo00261a003.
- ^ Cook G.R.; Barta N.S.; Stille J.R. (1992). "Lewis acid-promoted 3-aza-Cope rearrangement of N-alkyl-N-allyl enamines". Органикалық химия журналы. 57 (2): 461–467. дои:10.1021/jo00028a016.
- ^ а б c г. e f ж сағ мен Overman, L.E.; Mendelson, L. T.; Jacobsen, E. J. (1983). "Synthesis applications of aza-Cope rearrangements. 12. Applications of cationic aza-Cope rearrangements for alkaloid synthesis. Stereoselective preparation of cis-3a-aryloctahydroindoles and a new short route to Amaryllidaceae alkaloids". Дж. Хим. Soc. 105 (22): 6629–6637. дои:10.1021/ja00360a014.
- ^ а б c Overman, L. E. (1992). "Charge as a key component in reaction design. The invention of cationic cyclization reactions of importance in synthesis". Acc. Хим. Res. 25 (8): 352–359. дои:10.1021/ar00020a005.
- ^ Doering, W.v.E.; Roth, W. R. (1962). "The overlap of two allyl radicals or a four-centered transition state in the cope rearrangement". Тетраэдр. 18 (1): 67–74. дои:10.1016/0040-4020(62)80025-8.
- ^ а б c г. e Doedens, R. J.; Meier, G.P.; Overman, L.E. (1988). "Synthesis applications of cationic aza-Cope rearrangements. Part 17. Transition-state geometry of [3,3]-sigmatropic rearrangements of iminium ions". Дж. Орг. Хим. 53 (3): 685–690. дои:10.1021/jo00238a039.
- ^ Vogel, E.; Grimme, W.; Dinne, E. (December 1963). "Thermal Equilibrium between cis-1,2-Divinylcyclo-pentane and cis,cis-1,5-Cyclononadiene". Angewandte Chemie International Edition ағылшын тілінде. 2 (12): 739–740. дои:10.1002/anie.196307392.
- ^ Lukowski M.; Jacobs K.; Hsueh P.; Lindsay H.A; Milletti M.C. (2009). "Thermodynamic and kinetic factors in the aza-Cope rearrangement of a series of iminium cations". Тетраэдр. 65 (50): 10311–10316. дои:10.1016/j.tet.2009.10.010.
- ^ а б McCann, S. F.; Overman, L. E. (1987). "Medium Effects and the Nature of the Rate-Determining Step in Mannich-Type Cyclizations". Дж. Хим. Soc. 109 (20): 6107–6114. дои:10.1021/ja00254a033.
- ^ Overman, L. E.; Trenkle, W. C. (1997). "Controlling Stereoselection in Aza-Cope-Mannich Reactions". Isr. Дж.Хем. 37: 23–30. дои:10.1002/ijch.199700005.
- ^ а б Jacobsen E. J.; Levin J.; Overman L. E. (1988). "Synthesis applications of cationic aza-Cope rearrangements. Part 18. Scope and mechanism of tandem cationic aza-Cope rearrangement-Mannich cyclization reactions". Дж. Хим. Soc. 110 (13): 4329–4336. дои:10.1021/ja00221a037.
- ^ Маршалл, Дж. А .; Babler, J. H. (1969). "Heterolytic fragmentation of 1-substituted decahydroquinolines". Дж. Орг. Хим. 34 (12): 4186–4188. дои:10.1021/jo01264a104.
- ^ а б c г. e f Overman L. E.; Kakimoto, M. (1979). "Carbon-Carbon Bond Formation via Directed 2-Azonia-[3,3]-Sigmatropic Rearrangements. A New Pyrrolidine Synthesis". Дж. Хим. Soc. 101 (5): 1310–1312. дои:10.1021/ja00499a058.
- ^ а б c г. Overman L.E.; Kakimoto M.; Okawara M. (1979). "Directed 2-azonia-[3,3]-sigmatropic rearrangements. a convenient preparation of substituted 1-azaspiro[4,5]decanes". Тетраэдр хаттары. 20 (42): 4041–4044. дои:10.1016/s0040-4039(01)86498-4.
- ^ Armstrong, A.; Shanahan, S. E. (2005). "aza-Prins-pinacol approach to 7-azabicyclo[2.2.1]heptanes and ring expansion to [3.2.1]tropanes". Org. Летт. 7: 1335. дои:10.1021/ja00221a037.
- ^ aza-Prins-pinacol approach to 7-azabicyclo[2.2.1]heptanes and ring expansion to [3.2.1]tropanes Armstrong, A.; Shanahan, S. E. Org. Летт. 2005, 7, 1335
- ^ а б c г. R. B. Woodward; M. P. Cava; W. D. Ollis; A. Hunger; H. U. Daeniker; K. Schenker (1963). "The total synthesis of strychnine". Тетраэдр. 19 (2): 247–288. дои:10.1016/S0040-4020(01)98529-1. PMID 13305562.
- ^ Knight, S.D.; Overman, L. E.; Pairaudeau, G. (1993). "Synthesis applications of cationic aza-Cope rearrangements. 26. Enantioselective total synthesis of (−)-strychnine". Дж. Хим. Soc. 115 (20): 9293–9294. дои:10.1021/ja00073a057.
- ^ а б Overman, L. E.; Sugai, s. (1985). "Total Synthesis of (−)-Crinine. Use of Tandem Cationic Aza-Cope Rearrangement/Mannich Cyclizations for the Synthesis of Enantiomerically Pure Amaryllidaceae Alkaloids". Хельв. Хим. Акта. 68 (3): 745–749. дои:10.1002/hlca.19850680324.
- ^ а б Brueggemann, M.; McDonald, A. I.; Overman, L.E.; Rosen, M.D.; Schwink, L.; Scott, J.P. (2003). "Total Synthesis of (±)-Didehydrostemofoline (Asparagamine A) and (±)-Isodidehydrostemofoline". Дж. Хим. Soc. 125 (50): 15284–15285. дои:10.1021/ja0388820. PMID 14664560.
- ^ Overman, L. E.; Shim, J. (1993). "Synthesis applications of cationic aza-Cope rearrangements. Part 25. Total synthesis of Amaryllidaceae alkaloids of the 5,11-methanomorphanthridine type. Efficient total syntheses of (−)-pancracine and (.+-.)-pancracine". Органикалық реакциялар. 58 (17): 4662–4672. дои:10.1021/jo00069a032.
- ^ а б c г. Overman L. E.; Kakimoto, M.; Okazaki, M.E.; Meier, G.P. (1983). "Synthesis applications of aza-Cope rearrangements. 11. Carbon-carbon bond formation under mild conditions via tandem cationic aza-Cope rearrangement-Mannich reactions. A convenient synthesis of polysubstituted pyrrolidines". Дж. Хим. Soc. 105 (22): 6622–6629. дои:10.1021/ja00360a013.
- ^ Overman, L.E.; Fukaya, C. (1980). "Stereoselective total synthesis of (.+-.)-perhydrogephyrotoxin. Synthetic applications of directed 2-azonia-[3,3]-sigmatropic rearrangements". Дж. Хим. Soc. 102 (4): 1454–1456. дои:10.1021/ja00524a057.
- ^ Borch,R. Ф .; Bernstein, M. D.; Durst H. D. (1971). "Cyanohydridoborate anion as a selective reducing agent". Дж. Хим. Soc. 93 (12): 2897–2904. дои:10.1021/ja00741a013.
- ^ Grierson D. S.; Харрис М .; Husson, H.P. (1980). "Synthesis and chemistry of 5,6-dihydropyridinium salt adducts. Synthons for general electrophilic and nucleophilic substitution of the piperidine ring system". Дж. Хим. Soc. 102 (3): 1064–1082. дои:10.1021/ja00523a026.
- ^ а б c Overman, L. E.; Jacobsen, E. J. (1982). "The cyanomethyl group for nitrogen protection and iminium ion generation in ring-enlarging pyrrolidine annulations. A short synthesis of the amaryllidaceae alkaloid d,1-crinine". Тетраэдр Летт. 67 (51): 2741–2744. дои:10.1016/S0040-4039(00)87446-8.
- ^ а б c г. http://www.chem.uky.edu/research/cammers/thesis-pdf/2.pdf
- ^ а б c Jolidon, S.; Hansen, H. J. (1997). "Untersuchungen über aromatische Amino-Claisen-Umlagerungen". Хельв. Хим. Акта. 60 (2): 978–1032. дои:10.1002/hlca.19770600329.
- ^ Zahedi Ehsan; Ali-Asgari Safa; Keley Vahid (2010). "NBO and NICS analysis of the allylic rearrangements (the Cope and 3-aza-Cope rearrangements) of hexa-1,5-diene and N-vinylprop-2-en-1-amine: A DFT study". Central European Journal of Chemistry. 8 (5): 1097–1104. дои:10.2478/s11532-010-0084-1.
- ^ Brannock Kent; Burpitt Robert (1961). "Notes- The Chemistry of Isobutenylamines. II. Alkylation with Allylic and Benzyl Halides". Дж. Орг. Хим. 26 (9): 3576–3577. дои:10.1021/jo01067a645.
- ^ Baxter, E. W.; Labaree, D.; Ammon, H. L.; Mariano, P. S. (1990). "Formal total synthesis of deserpidine demonstrating a versatile amino-Claisen rearrangement/Wenkert cyclization strategy for the preparation of functionalized yohimbane ring systems". Дж. Хим. Soc. 12 (21): 7682–7692. дои:10.1021/ja00177a032.
- ^ Hill, R. K.; Gilman, N. W. (1967). "A nitrogen analog of the Claisen rearrangement". Тетраэдр хаттары. 8 (15): 1421–1423. дои:10.1016/S0040-4039(00)71596-6.
- ^ Boeckman, R. K.; Shair, M.D.; Vargas, R. J.; Stolz, L. A. (1993). "Synthetic and Mechanistic Studies of the retro-Claisen Rearrangement. 2. A Facile route to Medium-Ring Heterocycles via Rearrangement of Vinylcyclopropane- and Cyclobutanecarboxaldehydes". Дж. Орг. Хим. 58 (2): 1295–1297. дои:10.1021/jo00058a001.
- ^ Overman, L. E. (2009). "Molecular rearrangements in the construction of complex molecules". Тетраэдр. 65 (33): 6432–6446. дои:10.1016/j.tet.2009.05.067. PMC 2902795. PMID 20640042.
- ^ Siegfried Blechert (1989). "The Hetero-Cope Rearrangement in Organic Synthesis". Синтез. 1989 (2): 71–82. дои:10.1055/s-1989-27158.
