Ақша аудару кешені - Charge-transfer complex
A ақы аудару кешені (КТ кешені) немесе электронды-донорлы-акцепторлы кешен екі немесе одан да көп бірлестік болып табылады молекулалар, немесе бір үлкен молекуланың әртүрлі бөліктері, онда электронды зарядтың бөлігі молекулалық құрылымдар арасында ауысады. Нәтижесінде электростатикалық тарту молекулалық кешен үшін тұрақтандырушы күш береді. Заряд тасымалданатын бастапқы молекула деп аталады электронды донор ал қабылдаушы түрлерді деп атайды электрон акцепторы.
Заряд-тасымалдау кешеніндегі тартылыс сипаты тұрақты химиялық байланыс емес, сондықтан қарағанда әлсіз коваленттік күштер. Осындай көптеген кешендер өтуі мүмкін электронды ауысу ішіне қозғалған электрондық күй. Бұл ауысудың қозу энергиясы көрінетін аймақта өте жиі кездеседі электромагниттік спектр, ол осы кешендерге тән интенсивті түс береді. Мыналар оптикалық сіңіру жолақтары деп жиі аталады ақы аудару жолақтары (КТ жолақтары). Оптикалық спектроскопия бұл зарядты аудару жолақтарын сипаттайтын қуатты әдіс.
Заряд-тасымалдау кешендері молекулалардың көптеген түрлерінде, бейорганикалық, сондай-ақ органикалық және қатты, сұйық және ерітінділерде болады. Белгілі мысал - қалыптасқан кешен йод үйлескенде крахмал, ол қарқынды көгілдір заряд-трансферті көрсетеді.
Жылы бейорганикалық химия, зарядты тасымалдау кешендерінің көпшілігі металдар атомдары мен арасында электронды беруді қамтиды лигандтар. Өтпелі метал кешендерінің заряд-тасымалдау жолақтары заряд тығыздығы арасындағы ауысу нәтижесінде пайда болады молекулалық орбитальдар (MO) сипаты бойынша негізінен металл, ал сипаты бойынша негізінен лиганд. Егер ауыстыру MO-ден лиганд тәрізді сипаттамамен металға ұқсас жүрсе, онда комплекс лиганден-металға заряд беру (LMCT) кешені деп аталады. Егер электронды заряд МО-дан метал тәрізді сипаттамамен лиганд тәріздіге ауысса, онда комплекс металдан лигандқа заряд беру (MLCT) кешені деп аталады. Осылайша, MLCT метал центрінің тотығуына әкеледі, ал LMCT металл центрінің азаюына әкеледі. Резонанстық Раман спектроскопиясы[1] сонымен қатар осы кешендердегі заряд-трансфер жолақтарын тағайындау және сипаттау үшін күшті әдіс.
Донор-акцепторлық ассоциация тепе-теңдігі
Заряд-тасымалдау кешендері біреуі электрон доноры, ал екіншісі электрон акцепторы рөлін атқаратын молекулалардың немесе молекулалық топшалардың әлсіз бірлестігінен пайда болады. Ассоциация күшті ковалентті байланыс құрмайды және температураға, концентрацияға және иесіне, мысалы, еріткішке тәуелділікке ұшырайды.
Зарядты беру ассоциациясы тәуелсіз донор (D) және акцептор (A) молекулаларымен химиялық тепе-теңдікте болады:
Кванттық механика тұрғысынан бұл байланыспаған күй | D, A> және даталық күй | D арасындағы резонанс ретінде сипатталады+... A−>. Төмен күйдің пайда болуы - электронды ауысу, бұл түрлі-түсті сіңіру жолақтарын тудырады.
Сіңіру спектріндегі зарядты беру жолақтарының қарқындылығы осы ассоциация реакциясының дәрежесіне (тепе-теңдік константасы) тәуелді. Ерітіндідегі донорлық және акцепторлық компоненттердің концентрациясына тәуелді сіңіру жолақтарының интенсивтілігін өлшеу арқылы ерітіндідегі осы комплекстердің тепе-теңдік константасын анықтайтын әдістер жасалды. The Бенеси-Хильдебранд әдісі, оны әзірлеушілерге арналған, алдымен хош иісті көмірсутектерде еріген йодтың ассоциациясы үшін сипатталған.[2]
Өтпелі энергияны зарядтау-беру
Зарядты беру жолақтарының сіңіру толқын ұзындығы, яғни зарядты берудің ауысу энергиясы донорлар мен акцепторлық нысандардың нақты түріне тән.
Донор молекуласының электронды донорлық күші онымен өлшенеді иондану потенциалы, бұл электронды ең жоғарғы деңгейден алып тастауға қажет энергия молекулалық орбиталық. Электрон акцепторының электронды қабылдау қабілеті оның көмегімен анықталады электронға жақындық, бұл ең төменгі иесіз молекулалық орбиталды толтырған кезде бөлінетін энергия.
Жалпы энергия балансы (ΔE) - зарядты өздігінен беру кезінде алынған энергия. Ол акцептордың электронға жақындығы арасындағы айырмашылықпен анықталады (EA) және донордың иондану потенциалы (EМен), донор мен акцептор арасындағы электростатикалық тартылыс (J) арқылы реттеледі:[3]
Электромагниттік спектрдегі сипаттамалық КТ жолақтарының орналасуы осы энергия айырмашылығымен және резонанс тепе-теңдігінде байланыспаған және дербес күйлердің резонанс үлестерінің тепе-теңдігімен тікелей байланысты.
КТ жолақтарын анықтау
Зарядты аудару кешендері бойынша анықталады[1]
- Түс: КТ кешендерінің түсі донордан акцепторға электронды зарядтың ауысуы нәтижесінде пайда болатын салыстырмалы энергетикалық балансты көрсетеді.
- СолватохромизмШешімде ауысу энергиясы, демек күрделі түс еріткіштердің өткізгіштігінің өзгеруіне байланысты өзгеріп отырады, бұл ауысу нәтижесінде электрондар тығыздығының ауысымының өзгеруін көрсетеді. Бұл оны лигандтағы π * ← π ауысуларынан ерекшелендіреді.
- Қарқындылық: КТ сіңіру жолақтары қарқынды және көбінесе спектрдің ультрафиолет немесе көрінетін бөлігінде жатыр. Бейорганикалық кешендер үшін әдеттегі молярлық сіңіру қабілеттілігі ε 50000 л моль құрайды−1 см−1, бұл шамасы 20 л мольден typical -ден үш рет жоғары−1 см−1 немесе төмен, d-d ауысулары үшін (t-ден көшу2г еж). Себебі, КТ-ны айналдыруға рұқсат етілген және Лапорт -рұқсат. Алайда d-d ауысуларына спин рұқсат етілген, бірақ әрқашан Лапортеға тыйым салынған.
Зарядты берудің бейорганикалық кешендері
Зарядты тасымалдау металдардың қатысуымен жүретін бейорганикалық лиганд химиясында жиі кездеседі. Зарядтың берілу бағытына байланысты олар лиганд-металға (LMCT) немесе металдан-лигандқа (MLCT) зарядты беру болып бөлінеді.
Лиганден металға (иондық) заряд беру
LMCT кешендері электрондардың MO-ден лиганд тәрізді сипаттамаларға ие металдарға ауысуынан пайда болады. Егер бұл кешендерде салыстырмалы түрде жоғары энергетикалық жалғыз жұптары бар лигандалар болса (мысалы, S немесе Se) немесе металда төмен жатқан бос орбитальдар болса. Осындай көптеген кешендерде жоғары тотығу дәрежесінде металдар болады (тіпті d0). Бұл шарттар акцептор деңгейінің қол жетімді және энергияның төмен екендігін білдіреді.
D қарастырайық6 сегіздік кешен, мысалы IrBr63−, оның т2г деңгейлер толтырылды. Нәтижесінде 250 нм шамасында интенсивті жұтылу байқалады, бұл лиганд σ МО-дан бос e-ге ауысуға сәйкес келеді.ж MO. Алайда, IrBr62− бұл d5 біреуі 600 нм-ге, екіншісі 270 нм-ге жуық күрделі екі абсорбция байқалады. Себебі екі ауысу мүмкін, біреуінен t-ге дейін2г (ол енді тағы бір электронды орналастыра алады), ал екіншісі е-геж. 600 нм диапазоны t-ге ауысуға сәйкес келеді2г MO және 270 нм диапазоныж MO.
Зарядтың берілу жолақтары электрондардың лиганданың байланыспайтын орбитальдарынан э-ге ауысуынан да туындауы мүмкін.ж MO.
LMCT энергиясының тенденциясы
| +7 | MnO4− |
| +6 | CrO42− |
| +5 | VO43− |
Өтпелі кезеңдердің энергиясы электрохимиялық қатардың тәртібімен байланысты. Жеңілдетілген металл иондары энергияның ең төменгі ауысуларына сәйкес келеді. Жоғарыда аталған тенденция электрондардың лигандтан металға ауысуына сәйкес келеді, осылайша металл иондарының лигандпен азаюына әкеледі.
Мысалдарға мыналар жатады:
- MnO4− : Тетраэдрлік геометрияға ие перманганат ионы, қатты зардапты, негізінен толтырылған оттегі р орбитальдарынан марганецтен алынған бос МО-ға МО-дан алынған зарядтың берілуіне байланысты қатты күлгін түсті (VII).
- CdS: суретшінің кадмий-сары пигментінің түсі Cd-ден ауысуға байланысты2+ (5сек) ← С.2−(π).
- HgS: Hg салдарынан қызыл2+ (6с) ← С.2−(π) ауысу.
- Fe оксидтері: олар Fe (3d) ← O-дан ауысуға байланысты қызыл және сары түсті2−(π).
Металл (ион) -то-лиганд зарядының ауысуы
Металл (ион) -то-лиганд заряды-беру (MLCT) комплекстері электрондардың МО тәрізді сипаттағы металдар тәрізді сипаттамаларға ауысуынан пайда болады.[1][4] Бұл көбінесе төменгі π * орбитальдары бар лигандалары бар кешендерде, әсіресе хош иісті лигандаларда байқалады. Металл ионының тотығу саны аз болса, оның энергиясы аз болады, өйткені оның d орбитальдары энергиясы жағынан жоғары болады.
MLCT қатысатын осындай лигандтардың мысалдары келтірілген 2,2'-бипиридин (қос), 1,10-фенантролин (фен), CO, CN− және SCN−. Бұл кешендердің мысалдары:
- Трис (2,2'-бипиридил) рутений (II) : Бұл сарғыш түсті кешен зерттелуде,[5] өйткені осы зарядтың тасымалдануынан туындаған қозған күй өмір бойы микросекундқа ие және кешен жан-жақты фотохимиялық тотықсыздану реагенті болып табылады.
- W (CO)4(фен)
- Fe (CO)3(қос)
MLCT қозған күйлерінің фотоэффективтілігі
MLCT кешендерінің фотоэффективтілігі тотыққан металдың және тотықсызданған лигандтың табиғатынан туындайды. Дәстүрлі MLCT кешендерінің жағдайы ұнайды Ру (қосаяқ)32+ және Re (қос) (CO)3Cl ішкі реактивті емес еді, MLCT реактивті күйлерімен сипатталатын бірнеше MLCT кешендері синтезделді.
Фоглер мен Кункели[6] MLCT кешенін негізгі күйдің изомері деп санады, оның құрамында тотыққан металл және тотықсызданған лиганд бар. Осылайша, электрофильді шабуыл және редукцияланған лигандқа радикалды реакциялар, лигандтың азаюына байланысты металл центрінде тотықтырғыш қосу және сыртқы сфера зарядты беру реакциялары сияқты әртүрлі реакцияларды MLCT ауысуларынан туындайтын күйлерге жатқызуға болады. MLCT күйлерінің реактивтілігі көбінесе металдың тотығуына байланысты. Кейінгі процестерге ассоциативті лигандты алмастыру, экзиплекстің түзілуі және металдың --- металл байланысының бөлінуі жатады.
Зарядты ауыстыру кешендерінің түсі

D-d электронды ауысуларының арқасында көптеген металл кешендері боялған. Толқын ұзындығы дұрыс көрінетін жарық жұтылып, төменгі d-электронды жоғары қозған күйге жеткізеді. Жарықтың бұл сіңуі түс береді. Әдетте бұл түстер өте әлсіз. Бұл екі себепке байланысты таңдау ережелері:
- Айналдыру ережесі: Δ S = 0
Жылжыту кезінде электрон спиннің өзгеруіне ұшырамауы керек. Айналдырудың өзгеруін бастан кешіретін электронды ауысулар деп аталады айналдыруға тыйым салынған, мысалы айналдыруға тыйым салынған реакциялар.
- Лапорт ережесі: Δ l = ± 1
симметрия орталығы бар кешендерге d-d ауысуларына тыйым салынады - симметрияға тыйым салынған немесе Лапортқа тыйым салынған.[8]
Заряд-трансферлік кешендер d-d ауысуларын бастан кешірмейді. Осылайша, бұл ережелер қолданылмайды және тұтастай алғанда, абсорбциялар өте қарқынды.
Мысалы, заряд-тасымалдау кешенінің классикалық мысалы - йод пен крахмал арасында интенсивті күлгін түсті қалыптастыру. Бұл жалған валюта үшін өрескел экран ретінде кеңінен қолданылады. Көптеген қағаздардан айырмашылығы, АҚШ валютасында қолданылатын қағаздар ондай емес өлшемді крахмал қосылған. Осылайша, йод ерітіндісін қолданған кезде осы күлгін түстің пайда болуы контрафактіні білдіреді.
Басқа мысалдар
Гексафенилбензолдар сияқты H (2-сурет) зарядты тасымалдау кешендерін құруға өте жақсы мүмкіндік береді. Циклдік вольтамметрия үшін H H-ге сәйкес келетін 4 жақсы бөлінген максимумды көрсетеді+ H дейін4+ бірінші ионизациямен Е1/2 тек 0,51 eV. Тотығу мыналардан ареналар мысалы додекаметилкарборанил (B) көк кристалды қатты H-ге дейін+B− күрделі сондықтан оңай.[9]
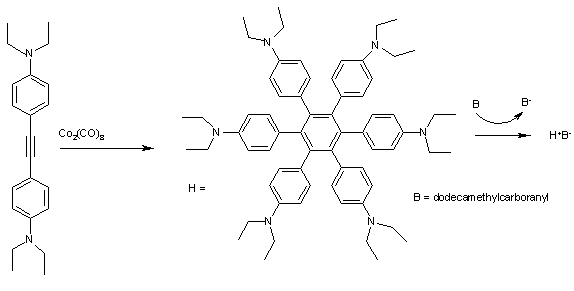
The фенил топтардың барлығы орталық хош иісті сақина мен оң зарядқа қатысты 45 ° иә бұрышында орналасқан радикалды катион сондықтан кеңістіктен бөлінген формасындағы 6 бензол сақинасы арқылы тороид. Кешенде 5 жұтылу жолағы бар жақын инфрақызыл нақты тағайындалуы мүмкін аймақ электрондық өтулер көмегімен деконволюция және Мулликен-Хуш теориясы.
Электр өткізгіштігі

1954 жылы зарядты ауыстыру тұзы меншікті коэффициенті 8 Ом · см-ге тең болатын перилен бірге йод немесе бром.[11][12] 1962 жылы танымал акцептор тетрацианохинодиметан (TCNQ) хабарланды. Тетратифулвален (TTF) 1970 жылы синтезделіп, күшті электрон доноры болып табылды. 1973 жылы осы компоненттердің тіркесімі күшті заряд-тасымалдау кешенін құрайтындығы анықталды, бұдан әрі TTF-TCNQ деп аталады.[13] Кешен ерітіндіде түзіледі және жақсы қалыптасқан кристалды қатты затқа айналуы мүмкін. Қатты металдың электр өткізгіштігін көрсетеді және алғашқы болып таза органикалық болып табылды дирижер. TTF-TCNQ кристалында TTF және TCNQ молекулалары бөлек параллель тураланған штабельдерде дербес орналасады және электрондар донордан (TTF) акцепторлық (TCNQ) шоғырларға ауысады. Демек, электрондар және электрон саңылаулары бөлінген және стектерде шоғырланған және стек бағытында электрлік потенциал қолданылған кезде сәйкесінше TCNQ және TTF бағандары бойымен бір өлшемді бағытта жүре алады.
Өткізгіштік тетраметил-тетраселенафулвален-гексафторофосфат (TMTSF) арқылы көрсетіледі2PF6), ол қоршаған орта жағдайында жартылай өткізгіш болып табылады, төменгі деңгейде асқын өткізгіштікті көрсетеді температура (сыни температура ) және жоғары қысым: 0.9 Қ және 12 кбар. Бұл кешендердегі токтың критикалық тығыздығы өте аз.
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б c Аткинс, П.Ж .; Шрайвер, Д.Ф. (1999). Бейорганикалық химия (3-ші басылым). Нью-Йорк: W.H. Фриман және CO. ISBN 0-7167-3624-1.
- ^ Х.Бенеси, Дж. Хильдебранд, Йодтың хош иісті көмірсутектермен өзара әрекеттесуін спектрофотометриялық зерттеу, Дж. Хим. Soc. 71 (8), 2703-07 (1949) дои: 10.1021 / ja01176a030.
- ^ Мулликен, Р. С .; Тұлға, W. B. (1969). Молекулалық кешендер. Нью-Йорк және Лондон: Вили-Интерсиснис. Бибкод:1971JMoSt..10..155B. дои:10.1016/0022-2860(71)87071-0. ISBN 0-471-62370-9.
- ^ Тарр, Дональд А .; Миесслер, Гари Л. (1991). Бейорганикалық химия (2-ші басылым). Englewood Cliffs, NJ: Prentice Hall. ISBN 0-13-465659-8.
- ^ Калянасундарам, К. (1992). Полипиридин және порфирин кешендерінің фотохимиясы. Бостон: Academic Press. ISBN 0-12-394992-0.
- ^ Фоглер, А .; Кункели, Х. (2000). «Зарядты металдан лигандқа ауыстыру қоздыруымен туындаған фотохимия». Келісім. Хим. Аян 208: 321. дои:10.1016 / S0010-8545 (99) 00246-5.
- ^ Housecroft, C. E .; Шарп, А.Г. (2008). Бейорганикалық химия (3-ші басылым). Prentice Hall. б. 541. ISBN 978-0-13-175553-6.
- ^ Роберт Дж. Ланкашир. «Электрондық спектроскопияны таңдау ережелері». Вест-Индия университеті, Мона. Алынған 30 тамыз 2008.
- ^ Дуоли Сан; Сергий В. Розоха; Джей К.Кочи (2005). «Бірнеше хош иісті орталықтар арасындағы кеңістіктегі (кофалық) -делокализация: гексафенилбензолға ұқсас радикалды катиондардағы тороидтық конъюгация». Angew. Хим. Int. Ред. 44 (32): 5133–5136. дои:10.1002 / anie.200501005.
- ^ Д.Чассо; Г.Комбертон; Дж. Готель; C. Hauw (1978). «Réexamen de la structure du complexe hexaméthylène-tétrathiafulvalène-tétracyanoquinodiméthane». Acta Crystallographica бөлімі B. 34: 689. дои:10.1107 / S0567740878003830.
- ^ Ю.Окамото және В.Бреннер Органикалық жартылай өткізгіштер, Рейнхольд (1964)
- ^ Х.Акамацу, Х.Инокучи және Ю.Мацунага (1954). «Перилен-Бром кешенінің электрөткізгіштігі». Табиғат. 173 (4395): 168. Бибкод:1954ж. 1773 ж., 168А. дои:10.1038 / 173168a0.CS1 maint: бірнеше есімдер: авторлар тізімі (сілтеме)
- ^ Андерсон П. В. П.А.Ли; М.Сайтох (1973). «TTF-TCNQ-де алып өткізгіштік туралы ескертулер». Тұтас күйдегі байланыс. 13: 595–598. Бибкод:1973SSCom..13..595A. дои:10.1016 / S0038-1098 (73) 80020-1.



