Никель (II) бис (ацетилацетонат) - Nickel(II) bis(acetylacetonate) - Wikipedia
 | |
 | |
| Атаулар | |
|---|---|
| Басқа атаулар Ни (acac)2, никельді акак | |
| Идентификаторлар | |
3D моделі (JSmol ) | |
| ChemSpider | |
| ECHA ақпарат картасы | 100.019.887 |
| EC нөмірі |
|
PubChem CID | |
| UNII | |
CompTox бақылау тақтасы (EPA) | |
| |
| |
| Қасиеттері | |
| C30H42Ни3O12 | |
| Молярлық масса | 770.734 г · моль−1 |
| Сыртқы түрі | қою жасыл |
| Тығыздығы | 1,455 г / см3 |
| Еру нүктесі | 229,5 ° C (445,1 ° F; 502,6 K) (ыдырайды) |
| Қайнау температурасы | ыдырайды |
| H2O | |
| Қауіпті жағдайлар | |
| GHS пиктограммалары |   |
| GHS сигналдық сөзі | Қауіп |
| H302, H317, H334, H350 | |
| P201, P202, P261, P264, P270, P272, P280, P281, P285, P301 + 312, P302 + 352, P304 + 341, P308 + 313, P321, P330, P333 + 313, P342 + 311, P363, P405, P501 | |
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |
| Infobox сілтемелері | |
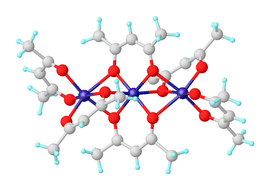
Никель (II) бис (ацетилацетонат) Бұл үйлестіру кешені [Ni (acac) формуласымен2]3, мұндағы акак - С анионы5H7O2− депротациядан алынған ацетилацетон. Сияқты органикалық еріткіштерде еритін қара-жасыл парамагнитті қатты зат толуол. Ол сумен әрекеттесіп, көк-жасыл ди бередіаквокешен Ни (acac)2(H2O)2.[1]
Құрылымы және қасиеттері
Сусыз никель (II) ацетилацетонаты Ni молекулалары түрінде болады3(ака)6. Үш никель атомы шамамен коллинеар және олардың әр жұбы екі мк көпірмен байланысқан2 оттегі атомдары Әрбір никель атомында тетрагональды бұрмаланған октаэдрлік геометрия бар, олардың арасындағы Ni-O байланыстарының ұзындығының айырмашылығы көпір және көпірсіз оксигендер.[2] Ни3(ака)6 центрлік симметриялы емес нүктелік тобына қарамастан, молекулалар центросимметриялы болады cis-Ni (acac)2 «мономерлер», бұл сирек кездеседі.[3] Тримерлі құрылым барлық никель орталықтарына октаэдрлік координацияға қол жеткізуге мүмкіндік береді. Тример никель орталықтарының жұптары арасында оттегі орталықтарының молекулалық бөлісуі болған жағдайда ғана пайда болады. Сусыз кешен қызықты магниттік қасиеттері. 80-ге дейінҚ ол қалыпты түрде көрінеді парамагнетизм тиімді магниттік моменті 3.2μB, d күтілетін айналу сәтіне жақын8 екі электронмен ион. Тиімді сәт 4,1 мк дейін көтеріледіB 4,3 К-да, байланысты ферромагниттік өзара алмасу никель иондарының үшеуін де қамтиды.[4]
Ацетилацетонат лигандының үлкен аналогтарымен байланысқан кезде стерикалық кедергі мононикель туындыларының пайда болуына ықпал етеді. Бұл мінез-3-метилацетилацетонаттың туындысы үшін байқалады.[5]
Дигидрат

Сусыз нысандағы сияқты, Ni (II) орталықтары октаэдрлік үйлестіру алаңдарын алады. Үйлестіру сферасын екі бидентат қамтамасыз етеді ацетилацетонат (акак) лигандалар және екі акво лигандтар. Ни (acac)2(H2O)2 цис және транс изомерлер ретінде тіршілік етеді.[6] Транс изомеріне цис изомерінен артықшылық беріледі (ол тек пиридин N-оксиді еріткіш ретінде қолданылған кезде ғана болған).[7] Транс изомерінде X тобы этанол еріткіштерінде Ni-O байланыстарын құра отырып, осьтік орынды алады. Бұл осьтік байланыстардың ұзындығы (2.1000Å) экваторлық Ni-O байланыстарына қарағанда (2.0085 Å және 1.9961Å) үлкен.[8]

Синтез
Бис (2,4-пентандионато) никелі (II) өңдеу арқылы дайындалады никель нитраты бірге ацетилацетон базаның қатысуымен. Өнім - көк-жасыл диакуо кешені Ni (CH)3COCHCOCH3)2(H2O)2.[9]
- Ni (ЖОҚ3)2 + 2 CH3COCH2COCH3 + 2 H2O + 2 NaOH → Ni (CH3COCHCOCH3)2(H2O)2 + 2 NaNO3
Бұл кешенді сусыздандыруға болады Дин-Старк тұзағы арқылы азеотропты айдау:[9]
- 3 Ni (CH3COCHCOCH3)2(H2O)2 → [Ni (CH3COCHCOCH3)2]3 + 6 H2O
Subliming Ni (acac)2(H2O)2 төмендетілген қысыммен (0,2-0,4 мм рт.ст.) 170-210 ° C кезінде сусыз түр береді.[3]
Реакциялар
Сусыз кешен Льюис негіздерінің диапазонымен әрекеттесіп, мономерлік қосылыстар береді:
- [Ni (CH3COCHCOCH3)2]3 + 6 L → 3 Ni (CH3COCHCOCH3)2L2
Ни (acac)2(H2O)2 изоцианаттардан диамидтер түзе отырып, метин позицияларында жоғары өнімділікте тез әрекеттеседі Осыған байланысты реакциялар диетил азодикарбоксилат және диметил ацетиленедикарбоксилат:
- Ни (acac)2(H2O)2 + 2 PhNCO → Ni (O2C5Мен2C (O) NHPh)2 + 2 H2O
Тример N, N-диметиламиноэтанол және сияқты негіздермен бөлінеді TMEDA.[10]
- [Ni (acac)2]3 + 3 чел → 3 [Ni (acac)2(чел)]
Қолданбалар
Сусыз кешен - никель негізіндегі катализаторлардың ізашары никель бис (циклооктадиен).
[Ni (acac)2]3 Бұл ізашары орналастыру үшін NiO жұқа пленка қолдану арқылы өткізгіш шыны астарларда зель-гель техникасы.[10]

Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ R. C. Мехротра; Р.Бора; D. P. Gaur (1978). Металл ß-дикетондар және одақтастар туындылары. Академиялық баспасөз. ISBN 0124881505.
- ^ Дж. Буллен, Р. Мейсон және П. Полинг (1961). «Никельдегі никельдің (II) бисацетилацетондағы октаэдрлік координациясы». Табиғат. 4761 (4761): 291–292. дои:10.1038 / 189291a0.
- ^ а б Дж. Буллен, Р. Мейсон және П. Полинг. (1965). «Бис (ацетилацетонато) никелінің (II) кристалды және молекулалық құрылымы». Бейорганикалық химия. 4 (4): 456–462. дои:10.1021 / ic50026a005.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Элементтер химиясы (2-ші басылым). Баттеруорт-Хейнеманн. б. 1157. ISBN 978-0-08-037941-8.
- ^ 1. А.Дюринг, Р.Годдард, П.В. Джолли, К. Крюгер, В.Р. Поляков, «Мономер-Тример изомериясы 3-алмастырылған пентан-2,4-дионды никель туындыларындағы» (II) «, Инорг. Химия 1997, 36, 177-183. дои:10.1021 / ic960441c
- ^ M. Kudrat-E-Zahan, Y. Nishida & H. Sakiyama (2010). «Электрлік спектрлерге негізделген ерітіндідегі бис (ацетилацетонато) никель (II) комплекстерінің цис / транс изомерлерін анықтау». Inorganica Chimica Acta. 363: 168–172. дои:10.1016 / j.ica.2009.09.011.
- ^ B. N. Figgis; М. Хичман (2000). «Лиганд өрісі теориясы және оның қолданылуы». Журналға сілтеме жасау қажет
| журнал =(Көмектесіңдер) - ^ О. Метин, Л. Т. Йылдырым және С. Озкар (2007). «Бис (ацетилацетонато) диметанолникель (II) синтезі, сипаттамасы және кристалдық құрылымы». Бейорганикалық химия. 10 (9): 1121–1123. дои:10.1016 / j.inoche.2007.06.011.
- ^ а б Виландт, Дж. В .; Рукербауэр, Д. (2010). «Бис (1,5-циклооктадиен) никель (0)». Бейорганикалық синтездер. 35: 120. дои:10.1002 / 9780470651568.ch6.
- ^ а б Пол А. Уильямс; Энтони С. Джонс; Джейми Ф.Бикли; Александр Штайнер; Hywel O. Davies; Тимоти Дж. Лидхэм; Сьюзан А. Импи; Джоанн Гарсия; Стивен Аллен; Алин Ружье; Александра Блир (2001). «Ni (II) ацетат пен Ni (II) ацетилацетонаттың диметиламиноэтанол қосымшаларының синтезі және кристалдық құрылымдары. Электрохромды никель оксидінің жұқа қабықшаларын соль-гельді тұндыруға арналған ізашарлар». Материалдар химиясы журналы. 11 (9): 2329–2334. дои:10.1039 / b103288g.
- ^ Шреста, Руджа; Дорн, Стефани С.М .; Weix, Daniel J. (2013-01-16). «Энондарға никель-катализденген редуктивті конъюгат қосылысы, аллилникель аралық өнімдері арқылы». Американдық химия қоғамының журналы. 135 (2): 751–762. дои:10.1021 / ja309176h. PMC 3547151. PMID 23270480.
