Пептидилпролил изомеразы А - Peptidylprolyl isomerase A
Пептидилпролил изомеразы А (PPIA), сонымен бірге циклофилин А (CypA) немесе ротамаза А болып табылады фермент адамдарда кодталған PPIA ген 7-хромосомада.[4][5][6] Пептидил-пролил цис-транс изомераза (PPIase) отбасының мүшесі ретінде бұл ақуыз катализдейді цис-транс изомеризация пролин имидикінің пептидтік байланыстар, соның арқасында көптеген биологиялық процестерді реттеуге мүмкіндік береді жасушаішілік сигнал беру, транскрипция, қабыну, және апоптоз.[4][7][8][9][10] Әр түрлі функцияларының арқасында PPIA кең ауқымда қолданылған қабыну аурулары, оның ішінде атеросклероз және артрит, және вирустық инфекциялар.[8][9][10]
Құрылым
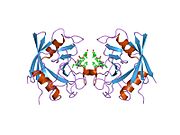
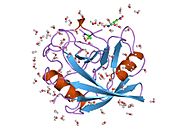
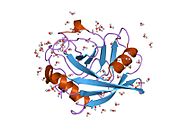
PPIA - 18 кДа, 165-амин қышқылы ұзақ цитозоликалық ақуыз.[11] Басқалар сияқты циклофилиндер, PPIA гидрофобты ядросы бар β баррель құрылымын құрайды. Бұл β баррель сегіз параллельге қарсы β-жіптерден тұрады және жоғарғы және төменгі жағында екі α-спиральмен жабылған.[7][11][12] Сонымен қатар, жіптердегі бұрылыстар мен ілмектер оқпанның икемділігіне ықпал етеді.[12] Оның белсенді учаскесі - құрамында пролин бар пептидтерді байланыстыратын гидрофобты қалта. Циклоспорин ақуыздың ферментативті белсенділігін тежеу үшін бұл қалтаны байлай алады.[7]
Функция
Бұл ген пептидил-пролил цис-транс изомеразасының мүшесін кодтайды (PPIase ) отбасы. PPIases пролин имидикалық пептидтік байланыстардың цис-транс изомерленуін катализдейді олигопептидтер және жеделдету ақуызды бүктеу.[4][11] Әдетте, PPIases барлығында кездеседі эубактериялар және эукариоттар, сондай-ақ бірнеше архебактериялар және, осылайша, жоғары деңгейде сақталған.[7][10] Адамға белгілі 18 циклофилиннің ішінде ППИА ең көп мөлшерде көрсетілген изозим болып табылады.[10] Атап айтқанда, PPIA көбінесе ядро және цитоплазма жасуша ішіндегі сигнал беруге, ақуызды тасымалдауға және транскрипцияны реттеуге қатысатын жасуша.[7][8][9][10][11] Гемопоэтикалық жасушаларда, ішкі жасушалық локализация кезінде ядродан цитоплазмаға дейін PPIA түзілуі байқалды c-Jun N-терминалды киназа - және серин протеазы - тәуелді микротүтікшенің бұзылуы. Бұл локализация G2 / M тоқтаумен байланысты болды, бұл ақуыздың PPIase функциясы жасуша циклі кезінде микротүтікшелер динамикасы арқылы реттелуі мүмкін екенін көрсетеді.[11] PPIA сонымен бірге байланысты болды митохондрия.[13]
Сонымен қатар, фермент жасушадан тыс жағдайда қабыну және апоптотикалық процестерге қатысады. Қатысуымен реактивті оттегі түрлері (ROS), тамырлы тегіс бұлшықет жасушалары (VSMC), моноциттер / макрофагтар және эндотелий жасушалары (EC) қабыну реакциясын тудыру және тіндердің зақымдануын жеңілдету үшін PPIA бөледі.[8][9][11][14] PPIA сонымен қатар іске қосылуы мүмкін Ақт және NF-κB сигнализациясы, нәтижесінде реттелуі Bcl-2, антиапоптотикалық ақуыз және осылайша жауап ретінде EC-де апоптоздың алдын алады тотығу стрессі.[9] PPIA сонымен қатар реттеуі мүмкін ERK1 / 2, JNK, р38 киназа, Ақт және IκB іске қосу арқылы сигнал беру жолдары CD147 рецептор.[11] ERK, JNK және p38 киназа жолдарының PPIA-дозаланған белсенділігі де ықпал етеді ангиогенез.[11] Сонымен қатар, PPIA жасуша миграциясын және тегіс бұлшықетте көбеюді тудырады.[8] Т жасушалары жағдайында PPIA Т-жасуша рецепторларын ынталандыру кезінде Т-жасушаға тән тирозинкиназа ИТК реттейді.[10]
Клиникалық маңызы
PPIA ақуызы маңызды апоптотикалық компонент болып табылады. Қалыпты кезде эмбриологиялық процестер немесе жасуша жарақаты кезінде (мысалы, ишемия-реперфузия жарақаты кезінде) жүрек соғысы және соққылар ) немесе әзірлемелер мен процестер кезінде қатерлі ісік, апоптотикалық жасуша құрылымдық өзгерістерге ұшырайды, соның ішінде жасушалардың кішіреюі, плазмалық мембрананың қан кетуі, ядролық конденсация және бөлшектер ДНҚ және ядро. Одан кейін тез жойылатын апоптотикалық денелерге бөлшектену жүреді фагоциттер, осылайша алдын-алу қабыну жауап.[15] Бұл тән морфологиялық, биохимиялық және молекулалық өзгерістермен анықталатын жасушалардың өлу режимі. Алдымен ол «кішірею некрозы» деп сипатталды, содан кейін бұл термин оның орнына қарама-қарсы рөлін көрсету үшін апоптозбен ауыстырылды митоз тіндік кинетикада. Апоптоздың кейінгі кезеңдерінде бүкіл жасуша бөлшектеніп, бірнеше плазмалық мембранамен шектелген апоптотикалық денелерді құрайды, олардың құрамында ядролық және немесе цитоплазмалық элементтер бар. -Ның ультрақұрылымдық көрінісі некроз митохондриялық ісіну, плазмалық мембрананың бұзылуы және жасушалық ыдырау негізгі ерекшеліктері болып табылады. Апоптоз көптеген жағдайларда кездеседі физиологиялық және патологиялық процестер. Кезінде маңызды рөл атқарады эмбрионалды Бағдарламаланған жасушалық өлім ретінде даму және «қажетсіз» жасушаларды жою механизмі ретінде қызмет ететін әр түрлі қалыпты инволюциялық процестермен бірге жүреді.
Қабынуға қарсы цитокин ретінде PPIA жедел және созылмалы қабыну ауруларына, соның ішінде жоғары дәрежеде қатысады сепсис, атеросклероз және ревматоидты артрит.[8][9][10] Осылайша, PPIA-ны таңдамалы ингибиторлармен терапевтік бағыттау осындай қабыну аурулары мен симптомдарымен күресуде тиімді болуы мүмкін.[9][10] Плазмадағы PPIA деңгейлері мен гипергликемия белгілері арасындағы корреляция PPIA диабет пен қан тамырлары ауруларының биомаркері ретінде қолданылуына ықпал етеді.[8]
Сонымен қатар, PPIA қатысады церебральды гипоксия -ишемия ядролық тасымалдауға үлес қосу арқылы AIF, проапоптотикалық фактор, нейрондарда.[10] Мидың қанындағы тосқауылдың тұтастығын сақтау және мидың зақымдануын жеңілдету үшін PPIA айналымдағы моноциттерді жинауға көмектеседі және өмір сүру мен өсу жолдарын ынталандырады.[8] Жүрек миогенді жасушаларында циклофилиндердің жылу соққысы және гипоксия-реоксигенация, сондай-ақ белсенділігі байқалады күрделі бірге жылу шокы белоктары. Осылайша, циклофилиндер ишемия кезінде кардиопротекция кезінде жұмыс істей аладыреперфузиялық жарақат.
Қазіргі уақытта PPIA экспрессиясы қатерлі ісік патогенезімен өте корреляцияланған, бірақ нақты механизмдері әлі анықталған жоқ.[11][14] PPIA шамадан тыс экспрессиясы байланысты болды гепатоцеллюлярлы карцинома, өкпе рагы, панкреатиялық аденокарцинома, эндометриялық карцинома, өңештің жалпақ жасушалы карциномасы, және меланома.[11][13]
Ақуыз бірнешеуімен әрекеттесе алады АҚТҚ ақуыздар, соның ішінде p55 gag, Vpr және капсид ақуыз және инфекциялық АИТВ қалыптастыру үшін қажет екендігі дәлелденді вириондар.[4][16] Нәтижесінде PPIA сияқты вирустық ауруларға ықпал етеді ЖИТС, гепатит С, қызылша, және тұмау А.[10]
Өзара әрекеттесу
Пептидилпролил изомеразасы А көрсетілген өзара әрекеттесу бірге:
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б c GRCh38: Ансамбльдің шығарылымы 89: ENSG00000196262 - Ансамбль, Мамыр 2017
- ^ «Адамның PubMed анықтамасы:». Ұлттық биотехнологиялық ақпарат орталығы, АҚШ Ұлттық медицина кітапханасы.
- ^ «Mouse PubMed анықтамасы:». Ұлттық биотехнологиялық ақпарат орталығы, АҚШ Ұлттық медицина кітапханасы.
- ^ а б c г. «Entrez Gene: PPIA пептидилпролил изомеразы А (циклофилин А)».
- ^ Haendler B, Hofer E (шілде 1990). «Адам циклофилин генінің және онымен байланысты өңделген псевдогендердің сипаттамасы». Еуропалық биохимия журналы / FEBS. 190 (3): 477–82. дои:10.1111 / j.1432-1033.1990.tb15598.x. PMID 2197089.
- ^ Holzman TF, Egan DA, Edalji R, Simmer RL, Helfrich R, Taylor A, Burres NS (ақпан 1991). «Адамның пептидил пролил изомераза циклофилинінің клондалған бейтарап изоэлектрлік түрінің алдын-ала сипаттамасы». Биологиялық химия журналы. 266 (4): 2474–9. PMID 1989998.
- ^ а б c г. e Kazui T, Inoue N, Yamada O, Komatsu S (қаңтар 1992). «Қолқа доғасының аневризмасына операция кезінде церебральды перфузия: қайта бағалау». Кеуде хирургиясының шежіресі. 53 (1): 109–14. дои:10.1016 / 0003-4975 (92) 90767-x. PMID 1530810.
- ^ а б c г. e f ж сағ мен Ramachandran S, Venugopal A, Kutty VR, A V, G D, Chitrasree V, Mullassari A, Pratapchandran NS, Santosh KR, Pillai MR, Kartha CC (7 ақпан 2014). «Циклофилиннің плазмадағы деңгейі 2 типті қант диабетімен ауыратын науқастарда жоғарылайды және қан тамырлары ауруларының болуын болжайды». Жүрек-қантамыр диабетологиясы. 13: 38. дои:10.1186/1475-2840-13-38. PMC 3922405. PMID 24502618.
- ^ а б c г. e f ж Вэй Y, Цзинчуан Y, И L, Jun W, Zhongqun W, Cuiping W (маусым 2013). «Эндотелий жасушаларында циклофилин А-ның антиапоптотикалық және проапоптотикалық сигнализациясы». Қабыну. 36 (3): 567–72. дои:10.1007 / s10753-012-9578-7. PMID 23180369. S2CID 24968009.
- ^ а б c г. e f ж сағ мен j к л Hoffmann H, Schiene-Fischer C (шілде 2014). «Жасушадан тыс циклофилиндердің функционалдық аспектілері». Биологиялық химия. 395 (7–8): 721–35. дои:10.1515 / hsz-2014-0125. PMID 24713575. S2CID 32395688.
- ^ а б c г. e f ж сағ мен j к Obchoei S, Wongkhan S, Wongkham C, Li M, Yao Q, Chen C (қараша 2009). «Циклофилин А: адамның қатерлі ісігі ауруларының әлеуетті функциялары және терапевтік мақсаты». Медициналық ғылым мониторы. 15 (11): RA221-32. PMID 19865066.
- ^ а б Ван Т, Юн Ч, Гу Сы, Чанг В.Р., Лян DC (тамыз 2005). «1.88 hCyP33 С аймағының кристалдық құрылымы: пептидил-пролил цис-транс изомеразасының жаңа домені». Биохимиялық және биофизикалық зерттеулер. 333 (3): 845–9. дои:10.1016 / j.bbrc.2005.06.006. PMID 15963461.
- ^ а б Ye Y, Huang A, Huang C, Liu J, Wang B, Lin K, Chen Q, Zeng Y, Chen Chen, Tao X, Wei G, Wu Y (2013). «Науқастардан гепатоцеллюлярлы карциноманың митохондриялық салыстырмалы протеомиялық анализі». Proteomics Clinic Appl. 7 (5–6): 403–15. дои:10.1002 / prca.201100103. PMID 23589362. S2CID 5906425.
- ^ а б Yao Q, Li M, Yang H, Chai H, Fisher W, Chen Chen (наурыз 2005). «Циклофилиндердің қатерлі ісіктердегі және басқа органдар жүйесіндегі рөлі». Дүниежүзілік хирургия журналы. 29 (3): 276–80. дои:10.1007 / s00268-004-7812-7. PMID 15706440. S2CID 11678319.
- ^ Керр Дж.Ф., Уилли А.Х., Карри А.Р. (1972 ж. Тамыз). «Апоптоз: тіндердің кинетикасына кең әсер ететін негізгі биологиялық құбылыс». Британдық қатерлі ісік журналы. 26 (4): 239–57. дои:10.1038 / bjc.1972.33. PMC 2008650. PMID 4561027.
- ^ Agarwal, PK (тамыз 2004). «А циклофилин А катализдейтін АИВ-1 капсидті ақуыздағы цис / транс изомеризациясы: есептеу және теориялық зерттеулерден түсініктер». Ақуыздар. 56 (3): 449–63. дои:10.1002 / прот.20135. PMID 15229879. S2CID 19907859.
- ^ Бразин К.Н., Маллис Р.Ж., Фултон Д.Б., Андреотти А.Х. (ақпан 2002). «Тирозинкиназа Itk пептидил-пролил изомераза циклофилин А арқылы реттелуі». Америка Құрама Штаттарының Ұлттық Ғылым Академиясының еңбектері. 99 (4): 1899–904. дои:10.1073 / pnas.042529199. PMC 122291. PMID 11830645.
Әрі қарай оқу
- Franke EK, Luban J (1995). «АИТВ-1 репликациясы мен патогенезіндегі циклофилин және гаг». АИТВ-инфекциясы кезіндегі жасушалардың активтенуі және апоптоз. Тәжірибелік медицина мен биологияның жетістіктері. 374. бет.217–28. дои:10.1007/978-1-4615-1995-9_19. ISBN 978-0-306-45063-1. PMID 7572395.
- Sokolskaja E, Luban J (тамыз 2006). «Циклофилин, TRIM5 және АҚТҚ-1-ге қарсы иммунитет». Микробиологиядағы қазіргі пікір. 9 (4): 404–8. дои:10.1016 / j.mib.2006.06.011. PMID 16815734.